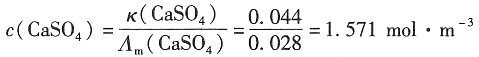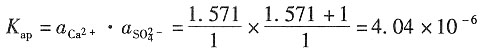一、选择题2. 某水溶液含0.1mol·kg
-1的Na
2SO
4和0.2mol·kg
-1的K
2SO
4,那么该溶液的离子强度为______。
- A.1.6mol·kg-1
- B.1.1mol·kg-1
- C.0.9mol·kg-1
- D.3.2mol·kg-1
A B C D
C
[解析] 根据离子强度公式:
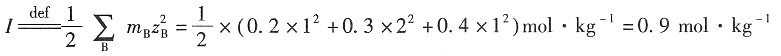
4. 298K,当H
2SO
4溶液的质量摩尔浓度从0.01mol·kg
-1增加到0.1mol·kg
-1时,其电导率κ和摩尔电导率Λ
m的变化将______。
- A.κ减小,Λm增加
- B.κ增加,以Λm增加
- C.κ减小,Λm减小
- D.κ增加,以Λm减小
A B C D
D
[解析] H2SO4为强电解质,强电解质的溶液的电导率随浓度的增加(即导电粒子的增多)而增加,摩尔电导率随浓度的增加而减小。当电解质的物质的量恒定,电导率只受电解质正负离子的迁移率影响。当浓度增加时,粒子间的相互作用增强,正、负离子的迁移率减小,因而摩尔电导率降低;当浓度降低时,粒子之间的相互作用力减弱,正负离子迁移率加快,摩尔电导率反而增大。
二、问答题1. 在300K和100kPa压力下,用惰性电极电解水以制备氢气。设所用直流电的强度为5A,电流效率为100%。如欲获得1m
3H
2(g),需通电多少时间?如欲获得1m
3O
2(g),需通电多少时间?已知在该温度下水的饱和蒸气压为3565Pa。
解:300K水的饱和蒸气压为3565Pa,外压为100kPa,根据分压定律,放出气体的分压为p
分=(100-3.565)kPa=96.435kPa。
设H
2和O
2为理想气体,则根据理想气体状态方程,可以分别求出:
放出H
2的物质的量为
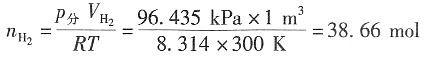
放出O
2的物质的量为
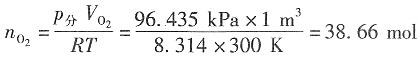
对于H
2,z=2,因Q=I·t=n
H2·z·F,故t=
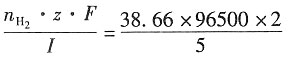
=1.49×10
6s≈414.5h
对于O
2,z=4,故
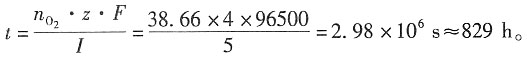
2. 用电解NaCl水溶液的方法制备NaOH,在通电一段时间后,得到了浓度为1.0mol·dm
-3的NaOH溶液0.6dm
3,在与之串联的铜库仑计中析出了30.4g Cu(s)。试计算该电解池的电流效率。
解:析出Cu的电解式为
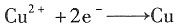
Cu的物质的量为
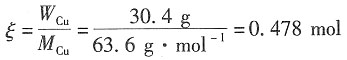
理论的电荷量为Q
理论=zFξ=2×96500×0.478=92254C
电解析出H
2同时得到OH
-的电解式为

其物质的量为
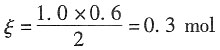
所以实际通过的电荷量为Q
实际=zFξ=2×96500×0.3=57900C
则电流效率为
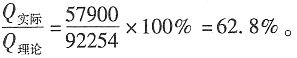
3. 用银电极来电解AgNO
3水溶液。通电一定时间后,在阴极上有0.078g的Ag(s)析出。经分析知道阳极部含有水23.14g,AgNO
30.236g。已知原来所用溶液的浓度为每克水中溶有AgNO
30.00739g。试分别计算Ag
+和NO
3-的迁移数。
解:电解出Ag的物质的量为
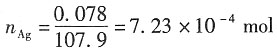
电解前,阳极部的Ag的物质的量为
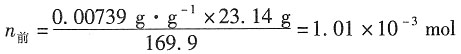
电解时,阳极部的Ag
+向阴极部移动
电解后,阳极部的Ag的物质的量为
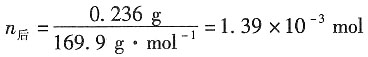
因阴极Ag
+进入溶液,通过的电量一样,故有
n
前+n
电=n
后+n
迁 n
迁=n
前+n
电-n
后=1.01×10
-3+7.23×10
-4-1.39×10
-3=3.43×10
-4mol
Ag
+的迁移数为:
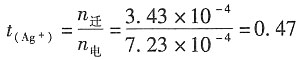
t
(NO3-)=1-0.47=0.53。
4. 在298K时,以Ag|AgCl为电极,电解KCl的水溶液。通电前溶液中KCl的质量分数为ω(KCl)=1.4941×10
-3,通电后在质量为120.99g的阴极部溶液中ω(KCl)=1.9404×10
-3。串联在电路中的银库仑计有160.24mg的Ag(s)沉积出来。试分别求K
+和Cl
-的迁移数。
解:阴极:

通电前后,阴极部K
+的迁移量为
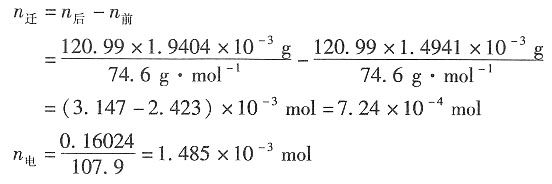
K
+的迁移数为

Cl
-的迁移数为t
(Cl-)=1-t
(K+)=0.512。
5. 氰化银钾络合物的化学表示式[Ag
n(CN)
m]
z-中n,m,z的值;
解:设氰化银钾络合物的化学式为Kx[Agn(CN)m]y,因为每通过1mol电子的电荷量,就析出1mol的Ag,故[Agn(CN)m]z-中Ag的物质量为1.4-1=0.4mol
则根据电量守恒,有n:m=0.4:0.8=1:2
即化学式中n=1,m=2,z=1
则氰化银钾络合物离子的化学式为[Ag(CN)2]-。
因络合离子[Agn(CN)m]z-中,z=1,根据物质的总带电量为零,可知x=1,y=1。
6. 氰化银钾络合物中正、负离子的迁移数。
解:氰化银钾络合物中正离子迁移数为0.6/1=0.6;负离子的迁移数为1-0.6=0.4。
7. [Cu(NH
3)
x]
2+离子中x的值;
解:通电前,因每1000g中含CuSO
415.96g,则100g水中含有CuSO
4的质量为=1.596g,则其物质的量为n
前=1.596/159.6=0.01mol。
通电后,阳极部的CuSO
4的量为2.091g,则有n
后=2.091/159.6=0.0131mol。
因在阳极部发生
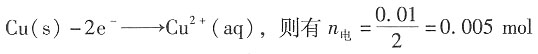
所以n
迁=n
前+n
电-n
后=0.01+0.005-0.0131=1.9×10
-3mol。
通电前,含有NH
3物质的量为0.1mol
通电后,含NH
3的物质量为1.571/17=0.0924mol
则通电前后,NH
3的物质量变化为0.1-0.0924=7.6×10
-3mol
所以
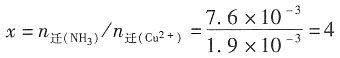
8. 该络合物离子的迁移数。
解:络合离子[Cu(NH
3)
x]
2+离子的迁移数为
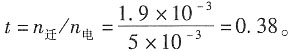
9. 在298K时,用Pb(s)作电极电解Pb(NO
3)
2溶液,该溶液的浓度为每1000g水中含有Pb(NO
3)
216.64g。当与电解池串联的银库仑计中有0.1658g银沉积后就停止通电。已知阳极部溶液质量为62.50g,经分析含有Pb(NO
3)
21.151g。试计算Pb
2+的迁移数。
解:析出的Ag的物质量为
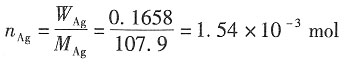
阳极部水的质量为(62.5-1.151)=61.349g
因通电前后水的质量不变,则通电前Ag(NO
3)的质量为

根据电荷守恒有n
电+n
后=n
前+n
迁 故Pb
2+的迁移量为
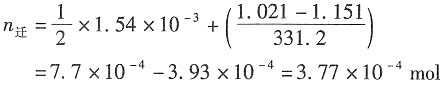
则Pb
2+的迁移数为:
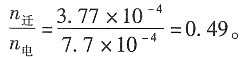
10. 298K时,在用界面移动法测定离子迁移数的迁移管中,首先注入一定浓度的某有色离子溶液,然后在其上面小心地注入浓度为0.01065mol·dm
-3的HCl水溶液,使其间形成一明显的分界面。通入11.54mA的电流,历时22min,界面移动了15cm。已知迁移管的内径为1.0cm,试求H
+离子的迁移数。
解:依题意有,迁移的电荷量为
n
迁=c·V=0.01065×1.5×π(0.05)
2=1.25×10
-4mol
电解的物质的量为
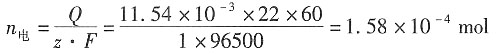
故过程的迁移数为
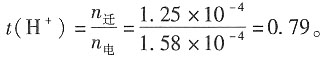
11. 在用界面移动法测定H
+离子的电迁移率(淌度)时,在历时750s后,界面移动了4.0cm。已知迁移管两极之间的距离为9.6cm,电位差为16.0V,设电场是均匀的。试求H
+离子的电迁移率。
12. 某电导池内装有两个直径为0.04m并相互平行的圆形银电极,电极之间的距离为0.12m。若在电导池内盛满浓度为0.1mol·dm
-3的AgNO
3溶液,施以20V电压,则所得电流强度为0.1976A。试计算电导池常数、溶液的电导、电导率和AgNO
3的摩尔电导率。
解:溶液的电导为
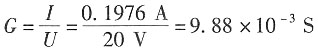
则溶液的电导率为
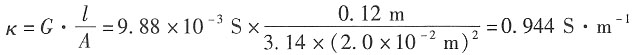
电池常数为
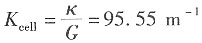
所以摩尔电导率为
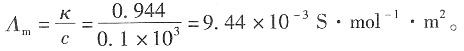
13. 电导池(1)的电导池常数;
解:依题意有,电导池(1)的电池常数为
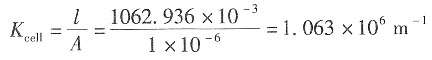
14. 在273.15K时,该KCl溶液的电导率。
解:因电导池(1)和(2)盛有相同的溶液,故电导率一样,则
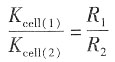
即K
cell(2)=
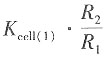
=1.063×10
6×0.107811=1.146×10
5m
-1 KCl溶液的电导率为
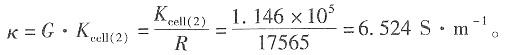
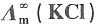 =1.2965×10-2S·m2·mol-1和
=1.2965×10-2S·m2·mol-1和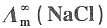 =1.0860×10-2S·m2·mol-1,K+和Na+的迁移数分别为tK+=0.496,tNa+=0.397。试求在291K和无限稀释时:
=1.0860×10-2S·m2·mol-1,K+和Na+的迁移数分别为tK+=0.496,tNa+=0.397。试求在291K和无限稀释时:15. KCl溶液中K
+和Cl
-的离子摩尔电导率;
16. NaCl溶液中Na
+和Cl
-的离子摩尔电导率。
解:同理可得
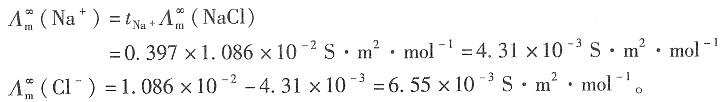
| c(NaCl)/(mol·dm-3) | 0.0005 | 0.0010 | 0.0020 | 0.0050 |
| R/Ω | 10910 | 5494 | 2772 | 1128.9 |
已知298K时,0.01mol·dm-3的KCl水溶液的电导率为κ(KCl)=0.1412S·m-1,试求:17. NaCl水溶液在不同浓度时的摩尔电导率Λ
m(NaCl);
解:电导池的电池常数为
K
cell=κ/G=κ·R=κ
(KCl)·R=0.142S·m
-1×484S
-1=68.728m
-1
则不同浓度下NaCl的电导率κΛ
m,如表所示。
| c/(mol·dm-3)
|
0.0005
|
0.0010
|
0.0020
|
0.0050
|
| κ/(S·m-1)
|
0.00630
|
0.01251
|
0.02479
|
0.06088
|
| Λ/(S·m2·mol-1)
|
0.01253
|
0.01244
|
0.01233
|
0.01211
|
18. 以Λ
m(NaCI)对
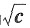
作图,求NaCl的无限稀释摩尔电导率
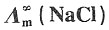
。
解:对强电介质,根据经验式有

故以Λ
m对
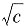
作图,如图所示,得到一直线,将直线外推,可以推得其截距,即
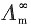
≈0.0127S·m
2·mol
-1。
19. 浓度为0.001mol·dm
-3NaNO
3溶液的电导率;
解:NaNO3溶液的电导率为
K=Λm(NaNO3)·c=1.21×10-2×0.001×103=1.21×10-2S·m-1。
20. 该电导池的常数K
cell;
解:电导池的常数为Kcell=κ·R=1.21×10-2×1650=19.97m-1。
21. 此电导池如充以浓度为0.001mol·dm
-3HNO
3溶液时的电阻及该HNO
3溶液的摩尔电导率。
解:依题意,可得在该浓度下,HCl的电导率为
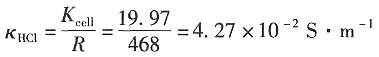
κ·R=1.21×10
-2×1650=19.97m
-1 则电导池的摩尔电导率为
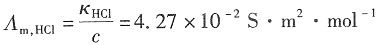
NaCl的电导率为
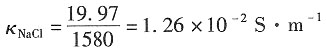
Λ
m,NaCl=1.26×10
-2S·m
2·mol
-1 Λ
m(HNO3)=Λ
m(HCl)+Λ
m(NaNO3)-Λ
m(HaCl) =(4.27+1.21-1.26)×10
-2S·m
2·mol
-1 =4.22×10
-2S·m
2·mol
-1 HNO
3的电导率为κ=Λ
m(HNO3)·c=4.22×10
-2×1=4.22×10
-2S·m
-1 所以电导池的电阻为
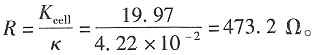
22. 298K时测得SrSO
4饱和水溶液的电导率为κ(SrSO
4)=1.482×10
-2S·m
-1,该温度时水的电导率为κ(H
2O)=1.496×10
-4S·m
-1。试计算在该条件下SrSO
4在水中的饱和溶液的浓度。
解:SrSO
4的电导率为
κ
(SrSO4)=κ
(溶液)-κ
(H2O)=1.482×10
-2-1.496×10
-4=1.467×10
-2S·m
-1 因溶液视为无限稀释的溶液,所以有
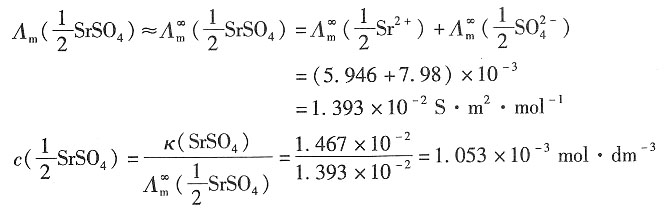
所以饱和溶液的浓度为c(SrSO
4)=
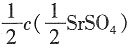
=5.266×10
-4mol·dm
-3。
23. 298K时,所用纯水的电导率为κ(H
2O)=1.60×10
-4S·m
-1。试计算该温度下PbSO
4(s)饱和溶液的电导率。已知PbSO
4(s)的溶度积为
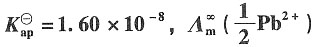
=7.0×10
-3S·m
2·mol
-1,
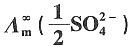
=7.98×10
-3S·m
2·mol
-1。
解:根据题意可得

则
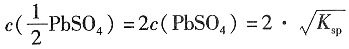
=2×1.26×10
-4=2.53×10
-4mol·dm
-3 PbSO
4电导率为
κ(PbSO
4)=
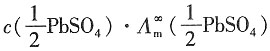
=2.53×10
-4×1.5×10
-2=3.8×10
-3S·m
-1 所以,该温度下,溶液的摩尔电导率为
κ(溶液)=κ(PbSO
4)+κ(H
2O)=3.8×10
-3+1.6×10
-4=3.96×10
-3S·m
-1。
24. 291K时,纯水的电导率为κ(H
2O)=3.8×10
-6S·m
-1。当H
2O(l)解离成H
+和OH
-并达到平衡时,求该温度下H
2O(l)的摩尔电导率、解离度和H
+的浓度。已知这时水的密度为998.6kg·m
-3。
解:已知纯水的密度为ρ
水=998.6kg·m
-3,则纯水的体积为
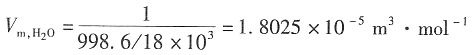
故纯水的摩尔电导率为
Λ
m(H
2O)=κ·V
m,H2O=1.8025×10
-5×3.8×10
-6=6.85×10
-11S·m
2·mol
-1 水在无限稀释状态下,摩尔电导率为
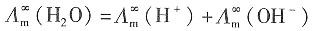
=3.498×10
-2+1.98×10
-2=5.478×10
-2S·m
2·mol
-1。
所以水的解离度为
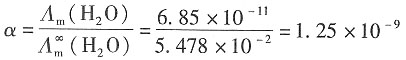
则H
+的浓度为
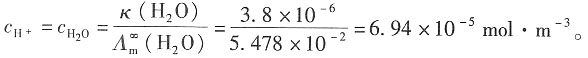
25. 根据如下数据,求H
2O(l)在298K时解离成H
+和OH
-并达到平衡时的解离度和离子积常数
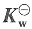
。已知298K时,纯水的电导率为κ(H
2O)=5.5×10
-6S·m
-1,
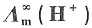
=3.498×10
-2S·m
2·mol
-1,
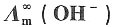
=1.98×10
-2S·m
2·mol
-1,水的密度为997.09kg·m
-3。
解:水的无限稀释状态的摩尔电导率为
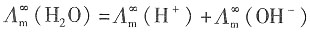
=3.498×10
-2+1.98×10
-2=5.478×10
-2S·m
2·mol
-1 纯水的摩尔电导率为
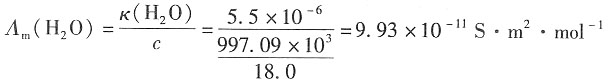
则解离度为
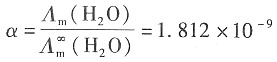
H
+的浓度为
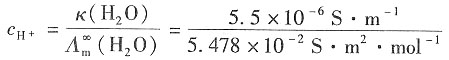
=1.004×10
-4mol·m
3=1.004×10
-7mol·dm
-3 离子积常数为
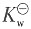
=(c
H+)
2=(1.004×10
-7)
2mol·dm
-3=1.008×10
-14mol·dm
-3。
26. 在298K时,浓度为0.01mol·dm
-3的CH
3COOH溶液在某电导池中测得其电阻为2220Ω,已知该电导池常数为K
cell=36.7m
-1。试求在该条件下CH
3COOH的解离度和解离平衡常数。
解:CH
3COOH溶液的电导率为
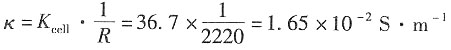
因为
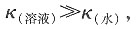
故κ
(溶液)≈κ
CH3COOH,则有
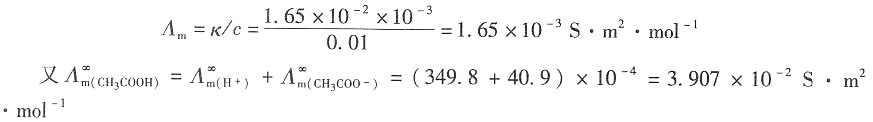
所以,该条件下的解离度为

平衡时,各物质的状态为

所以,解离平衡常数为
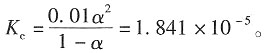
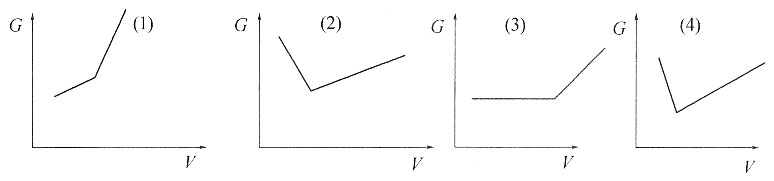
27. 画出下列电导滴定的示意图
(1)用NaOH滴定C
6H
5OH;(2)用NaOH滴定HCl;(3)用AgNO
3滴定K
2CrO
4;(4)用BaCl
2滴定Tl
2SO
4。
解:电导变化与溶液中离子有关,以电导G为纵坐标,所用滴定液的体积V为横坐标作图,如图所示。
(1)为强碱滴定弱酸;(2)为强碱滴定强酸;(3)为沉淀反应;(4)为反应后的两种产物的均为微溶性的盐。
28. 298K时,在某一电导池中充以浓度为0.01mol·dm
-3、电导率为0.14114S·m
-1的KCl溶液,测得其电阻为525Ω。若在该电导池内充以0.10mol·dm
-3的NH
3·H
2O溶液时,测得电阻为2030Ω,已知此时所用水的电导率为2.0×10
-4S·m
-1。试求:
(1)该NH
3·H
2O溶液的解离度;
(2)若该电导池内充以纯水时的电阻值。
解:查教材表,可得

(1)电导池常数为K
cell=κ·R=0.14114×525=74.10m
-1 则氨水的无限稀释摩尔电导率为
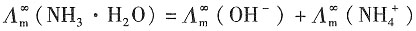
=1.98×10
-7+73.4×10
-4=2.741×10
-2S
-1·m
2·mol
-1 纯氨水的摩尔电导率为
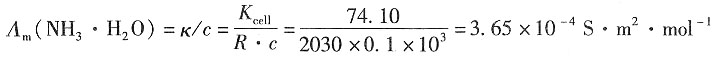
所以氨水的解离度为
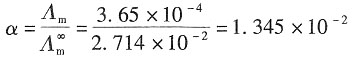
(2)因为电导池常数表达式为
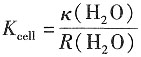
所以电导池的电阻为
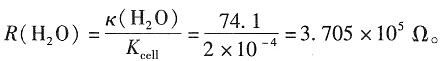
29. 298K时,已知:
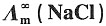
=1.086×10
-2S·m
2·mol
-1,
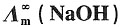
=2.172×10
-2S·m
2·mol
-1和

=1.298×10
-2S·m
2·mol
-1;又已知NH
3·H
2O在浓度为0.1mol·dm
-3时的摩尔电导率Λ
m=3.09×10
-4S·m
2·mol
-1,浓度为0.01mol·dm
-3时的摩尔电导率为Λ
m=9.62×10
-4S·m
2·mol
-1。试根据上述数据求NH
3·H
2O的两种不同浓度溶液的解离度和解离常数。
解:根据题意可得
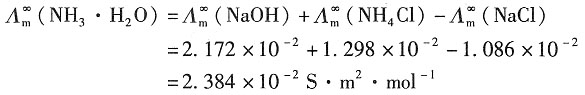
当NH
3·H
2O的浓度为0.1mol·dm
-3时,其解离度为
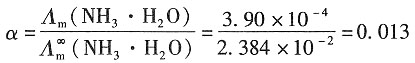
平衡时,溶液的各物质的量为
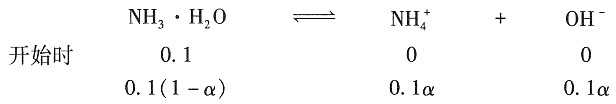
所以此时氨水的解离平衡常数为
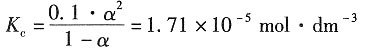
当氨水的浓度为0.01mol·dm
-3时,同理可得
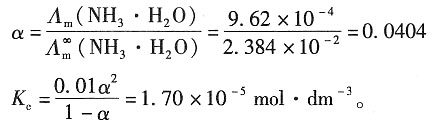
30. 291K时,在一电场梯度为1000V·m
-1的均匀电场中,分别放入含H
+,K
+,Cl
-的稀溶液,试求各个离子的迁移速率。已知各溶液中离子的摩尔电导率分别为:
| 离子 | H+ | K+ | Cl- |
| Λm/(10-3S·m2·mol-1) | 27.8 | 4.8 | 4.9 |
解:因1mol离子所带的电荷量与离子电迁移率的乘积为离子的摩尔电导率,即
Λ
m=A·e·u
m+=F·u
m+ 所以电子的迁移速率表达式为
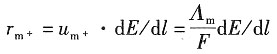
则各离子的迁移速率分别为
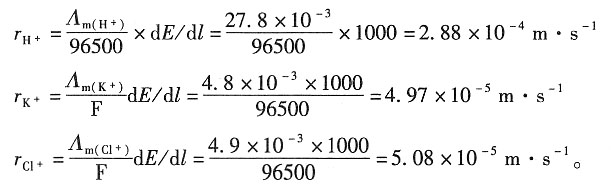
31. NaCl;
解:NaCl溶液的离子强度为
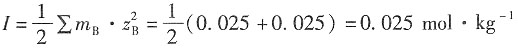
32. MgCl
2;
解:MgCl
2溶液的离子强度为
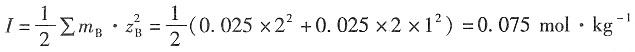
33. CuSO
4;
解:CuSO
4溶液的离子强度为
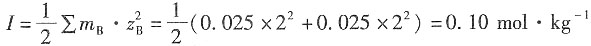
34. LaCl
3;
解:LaCl
3溶液的离子强度为
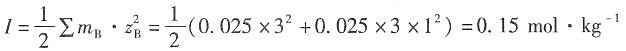
35. NaCl和LaCl
3的混合溶液,浓度各为0.025mol·kg
-1。
解:NaCl+LaCl
3溶液的离子强度为

36. NaCl(γ
±=0.904);
解:NaCl的离子平均质量摩尔浓度为
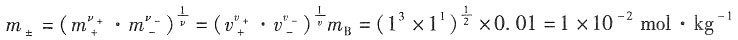
离子平均活度a
±=
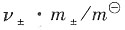
=0.904×1×10
-2mol·kg
-1/1mol·kg
-1=9.04×10
-3 电解质的活度a
B=(a
±)
v=(9.04×10
-3)
2=8.17×10
-5
37. K
2SO
4(γ
±=0.715);
解:K
2SO
4的离子平均质量摩尔浓度m
±、离子平均活度a
±以及电解质的活度a
B分别如下:
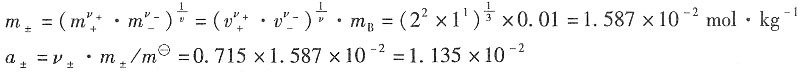
a
B=(a
±)
v=(1.135×10
-2)
3=1.462×10
-6
38. CuSO
4(γ
±=0.444);
解:CuSO
4的离子平均质量摩尔浓度m
±、离子平均活度a
±以及电解质的活度a
B分别如下:
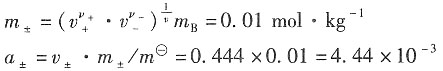
a
B=(a
±)
v=(4.44×10
-3)
2=1.971×10
-5
39. K
3[Fe(CN)
6](γ
±=0.571)。
解:K
3[Fe(CN)
6]的离子平均质量摩尔浓度m
±、离子平均活度a
±以及电解质的活度a
B分别如下:
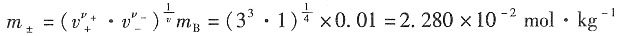
a
±=
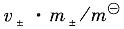
=0.571×2.28×10
-2=1.302×10
-2 a
B=(a
±)
v=(1.302×10
-2)
4=2.870×10
-8。
40. 有下列不同类型的电解质:①HCl;②MgCl
2;③CuSO
4;④LaCl
3;⑤Al
2(SO
4)
3。设它们都是强电解质,当它们的溶液浓度分别都是0.025mol·kg
-1时,试计算各种溶液的:
(1)离子强度I;
(2)离子平均质量摩尔浓度m
±;
(3)用Debye-Hückel公式计算离子平均活度因子γ
±;
(4)计算电解质的离子平均活度a
±和电解质的活度a
B。
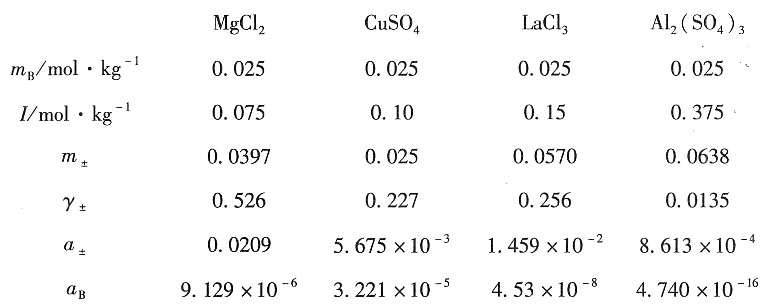
解:以HCl为例
(1)HCl的离子强度为I=

×0.025×(1+1)=0.025mol·kg
-1 (2)HCl的离子平均质量摩尔浓度为
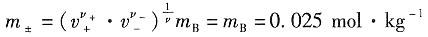
(3)根据Debye-Hückel公式,有
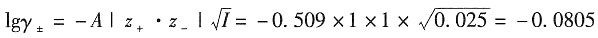
解得离子平均活度因子为γ
±=0.831。
(4)HCl电解质的离子平均活度a
±为a
±=
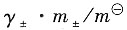
=0.831×0.025=0.0208
HCl电解质的活度a
B为a
B=a
v±=(0.0208)
2=4.316×10
-4 同理,其他电解质如下:
41. 试用Debye—Hückel修正公式计算298K时浓度为0.001mol·kg
-1的K
3[Fe(CN)
6]溶液的平均活度因子(已知实验值为0.808)。
解:溶液的离子强度为
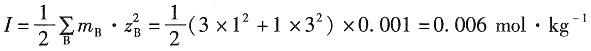
根据Debye—Hückel修正公式,有
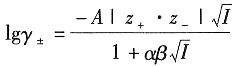
在298K时,A取
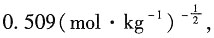
离子半径与β的积近似为1,所以有
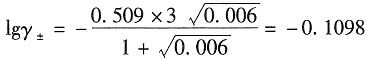
解得γ
±=0.777。
42. 在298K时,某溶液含MgCl
2和ZnSO
4的浓度均为0.002mol·kg
-1。试用Debye—Hückel极限公式求ZnSO
4的离子平均活度因子。
解:溶液的离子强度为
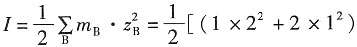
×0.002+(1×2
2+1×2
2)×0.002]=0.014mol·kg
-1 根据Debye—Hückel公式,有
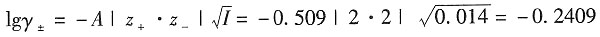
解得γ
±=0.5742。
43. 298K时,CO
2(g)饱和水溶液的电导率为1.87×10
-4S·m
-1,已知该温度下纯水的电导率为6.0×10
-6S·m
-1,假定只考虑碳酸的一级解离,并已知该解离常数
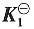
=4.31×10
-7。试求CO
2(g)饱和水溶液的浓度。已知
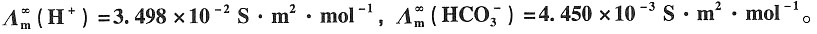
解:CO
2(g)饱和水溶液的浓度为c,则其电导率为
κ
(H2CO3)=κ
溶液-κ
(H2O) =1.87×10
-4-6.0×10
-6 =1.81×10
-4S·m
-1 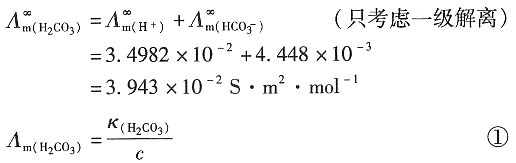
解高度

把①式代入②式得:
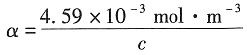
又∵

所以α=9.39×10
-5.
c=48.88mol·m
-3=4.888×10
-2mol·dm
-3。
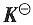 =1.8×10-5,试计算在下列不同情况下醋酸在浓度为1.0mol·kg-1时的解离度。
=1.8×10-5,试计算在下列不同情况下醋酸在浓度为1.0mol·kg-1时的解离度。44. 设溶液是理想的,活度因子均为1;
解:HAc的解离平衡为
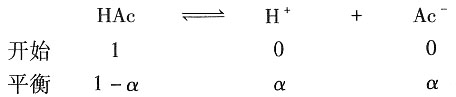
则解离平衡常数为
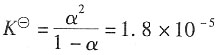
所以解离度为α=3.335×10
-3
45. 用Debye-Hückel极限公式计算出γ
±的值,然后再计算解离度。设未解离的HAc的活度因子为1。
解:由上一小题得[H
+]=[Ac
-]=3.335×10
-3mol·kg
-1 溶液的离子强度为I=
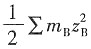
=3.335×1
-3~mol·kg
-1 根据德拜-休克尔公式,有
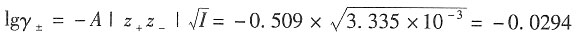
解得γ
±=0.935
溶液的解离平衡常数可表示为

m
H+与m
HAc相比很小。
所以K
a=(γ
±)
2·α
2,即1.8×10
-5=(0.935)
2×α
2,解得α=4.54×10
-3。
46. 电解质溶液的浓度和离子所带的电荷对平均活度因子都是有影响的。用Debye-Hückel公式计算下列强电解质NaCl,MgCl
2和FeCl
3在浓度分别为1.0×10
-4mol·kg
-1和5.0×10
-4mol·kg
-1时的离子平均活度因子。
解:NaCl m=1×10
-4时,
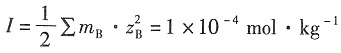
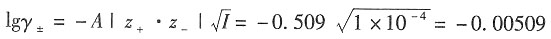
γ
±=0.988
m=5×10
-4mol·kg
-1时,I=5×10
-4mol·kg
-1 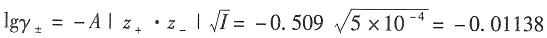
γ
±=0.974
MgCl
2 在298K时
m=1×10
-4mol·kg
-1时,I=
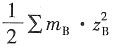
=3×10
-4mol·kg
-1 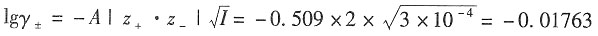
γ
±=0.96
m=5×10
-4mol·kg
-1时,I=1.5×10
-3mol·kg
-1 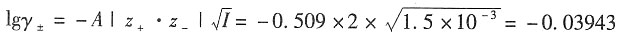
γ
±=0.913
FeCl
3 m=1×10
-4mol·kg
-1时,I=6×10
-4mol·kg
-1 γ
±=0.917
m=5×10
-4mol·kg
-1时,I=3.0×10
-3mol·kg
-1 γ
±=0.825。
47. 不考虑活度因子的影响,即设γ
±=1;
解:依题意知,不考虑活度因子的影响,即γ
±=1。
则PbCl
2在水溶液中的活度积为
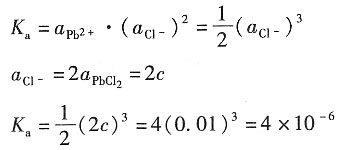
加入到NaCl溶液中Cl
-浓度是NaCl解离出的Cl
-与PbCl
2中解离出的Cl
-之和,所以有
K
ap=a
PbCl2·(a
PbCl2+a
NaCl)
2=4×10
-6 a(a+0.1)
2=4×10
-6 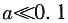
所以a·(0.1)
2=4×10
-6 解得m=a=4×10
-4mol·kg
-1
48. 用Debye-Hückel公式计算PbCl
2的γ
±后,再求其饱和溶液的浓度(计算中可作合理的近似)。
解:先求K
sp 溶液的离子强度表达式为
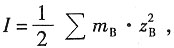
所以有
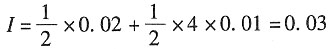
则根据德拜-休克尔公式有
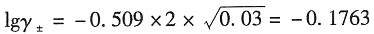
解得γ
±=0.666
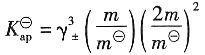
=0.666
3×0.01×(2×0.01)
2=1.182×10
-6 加入NaCl后,由于Cl
-离子浓度很高,故离子强度近似为0.1,可忽略PbCl
2的贡献。
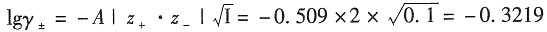
解得,γ
±=0.477
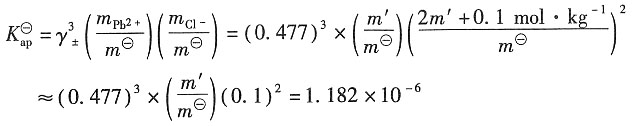
得,m'=0.001089mol·kg
-1
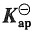 =a+·a-=5.77×10-5(计算中可作合理的近似)。
=a+·a-=5.77×10-5(计算中可作合理的近似)。49. 在纯水中;
解:因纯水中,γ
±≈1,溶解度很小,故m=a
+=a
-,则解离平衡常数为
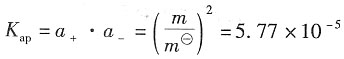
解得m=7.60×10
-3mol·kg
-1 所以溶解度为
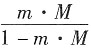
≈m·M=7.6×10
-3×235.8×10
-3=1.79×10
-3。
50. 在0.01mol·kg
-1的KBrO
3溶液中。
解:在0.01mol·kg
-1的KBrO
3溶液中,KBrO
3完全电离,所以溶液的离子强度为
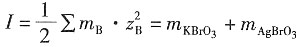
因KBrO
3的浓度很小,对AgBrO
3的溶解度几乎没有影响,故m
AgBrO3=0.0076mol·kg
-1。
离子强度为I≈0.01+0.0076=1.76×10
-2mol·kg
-1 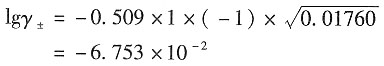
又γ
±=0.856 m
+=m m
-=m+0.01
故
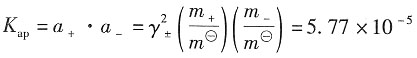
(0.856)
2·m(m+0.01)=5.77×10
-5 解得m=5.19×10
-3mol·kg
-1 同理,溶解度为m·M=5.19×10
-3×235.8×10
-3=1.22×10
-3kg·mol
-1。
51. 计算在浓度为0.1mol·kg
-1的NaNO
3溶液中(设pH等于7.0),AgA(s)的饱和溶液的浓度。在该pH下,A
-离子的水解可以忽略:
解:在0.1mol·dm
-3的NaNO
3溶液中,AgA的浓度远低于NaNO
3的浓度。
溶液的离子强度为
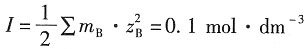
则根据德拜-休克尔公式,有
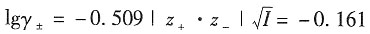
解得γ
±=0.69
溶液的解离平衡常数为K
ap=a
+·a
-=
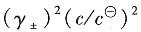
=1×10
-8 则溶液的浓度为c=1.45×10
-4mol·dm
-3。
52. 设AgA(s)在浓度为0.001mol·kg
-1的HNO
3溶液中的饱和浓度为1.3×10
-4mol·kg
-1,计算弱有机酸HA的解离平衡常数
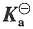
。
解:离子强度为
I=
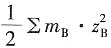
=m
HNO3+m
AgA=1×10
-3+1.3×10
-4=1.13×10
-3mol·dm
-3 根据德拜-休克尔公式
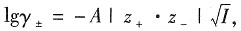
解得γ
±=0.961
因解离平衡常数为
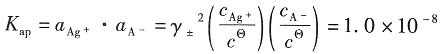
则 c
Ag+=c
AgA=1.3×10
-4mol·dm
-3 c
A-=8.33×10
-5mol·dm
-3 所以

三、计算题1. 已知25℃时用纯水配制的AgBr饱和水溶液的电导率为1.664×10
-5S·m
-1,此时纯水的电导率为5.5×10
-6S·m
-1,Ag
+和Cl
-的无限稀释摩尔电导率61.92×10
-4和78.4×10
-4S·m
2·mol
-1,计算AgBr(s)的溶度积。
解:依题意可知
κ(AgBr)=κ(溶液)-κ(H
2O)=(1.664-0.55)×10
-5S·m
-1=1.114×10
-5S·m
-1 
=(61.92+78.4)×10
-4S·m
2·mol
-1=1.403×10
-2S·m
2·mol
-1 由于难溶盐的溶解度很小,溶液极稀,所以可以认为
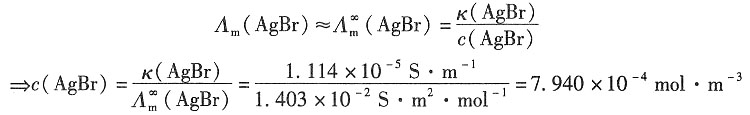
所以AgBr(s)的溶度积K
sp可表示为
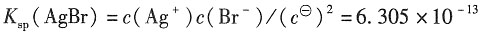
其中,
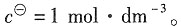
2. 已知浓度为0.001mol·dm
-3的Na
2SO
4溶液的电导率为2.6×10
-2Ω
-1·m
-1,当该溶液饱和了CaSO
4后,电导率变为0.07Ω
-1·m
-1。已知Na
+和1/2 Ca
2+的摩尔电导率分别为5.0×10
-3和6.0×10
-3Ω
-1·m
-2·mol
1求CaSO
4的活度积。(设活度系数为1)
解:由题可知CaSO
4的电导率和Na
2SO
4的摩尔电导率分别为:
κ(CaSO
4)=(0.07-0.026)=0.044Ω
-1·m
-1 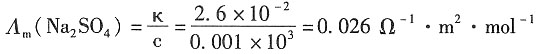
则
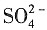
和CaSO
4的摩尔电导率分别为:

=Λ
m(Na
2SO
4)-2λ
m(Na
+)=0.016-2×5.0×10
-3=0.016Ω
-1·m
2·mol
-1 Λ
m(CaSO
4)=
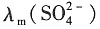
+λ
m(Ca
2+)=0.016+2×6.0×10
-3=0.028Ω
-1·m
2·mol
-1 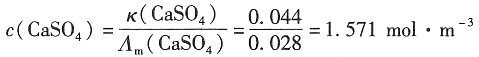
CaSO
4的活度积为:
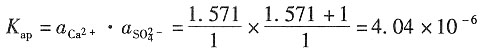
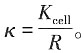
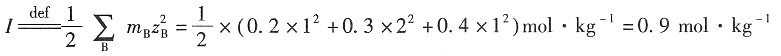
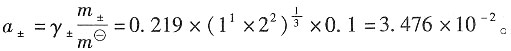
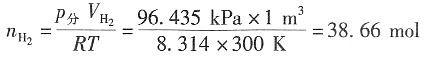
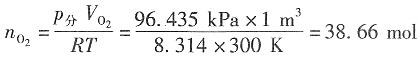
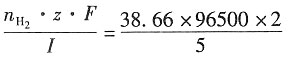 =1.49×106s≈414.5h
=1.49×106s≈414.5h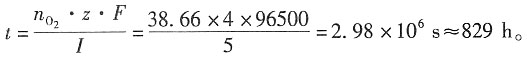
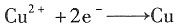
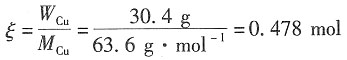

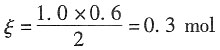
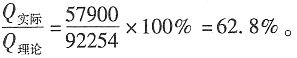
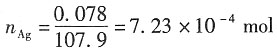
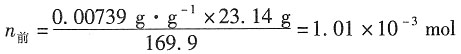
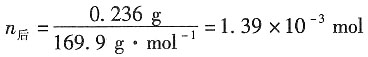
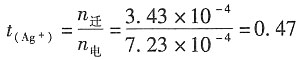

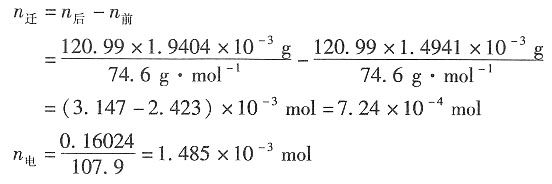

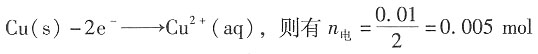
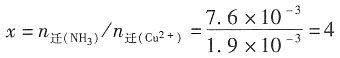
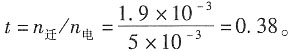
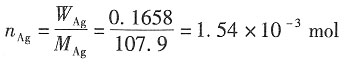

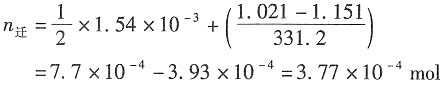
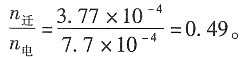
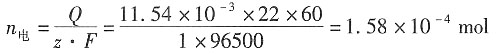
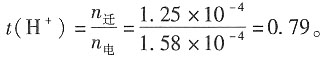
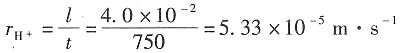
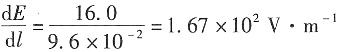
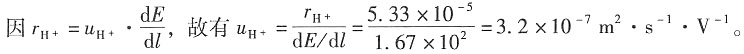
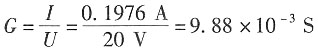
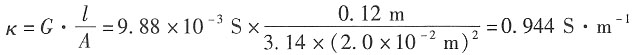
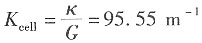
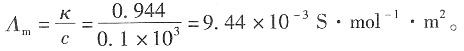
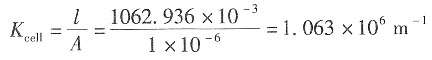
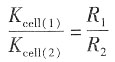
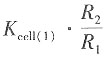 =1.063×106×0.107811=1.146×105m-1
=1.063×106×0.107811=1.146×105m-1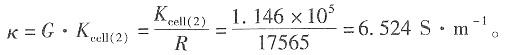
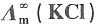 =1.2965×10-2S·m2·mol-1和
=1.2965×10-2S·m2·mol-1和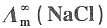 =1.0860×10-2S·m2·mol-1,K+和Na+的迁移数分别为tK+=0.496,tNa+=0.397。试求在291K和无限稀释时:
=1.0860×10-2S·m2·mol-1,K+和Na+的迁移数分别为tK+=0.496,tNa+=0.397。试求在291K和无限稀释时: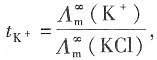 所以
所以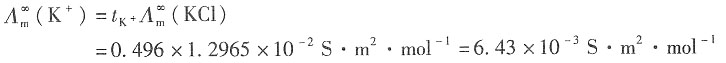

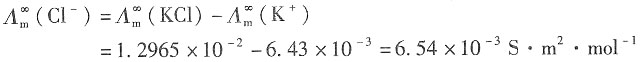
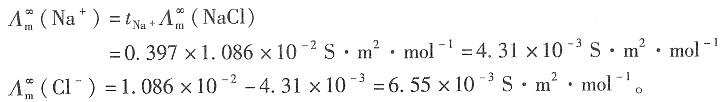
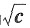 作图,求NaCl的无限稀释摩尔电导率
作图,求NaCl的无限稀释摩尔电导率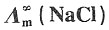 。
。 故以Λm对
故以Λm对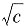 作图,如图所示,得到一直线,将直线外推,可以推得其截距,即
作图,如图所示,得到一直线,将直线外推,可以推得其截距,即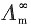 ≈0.0127S·m2·mol-1。
≈0.0127S·m2·mol-1。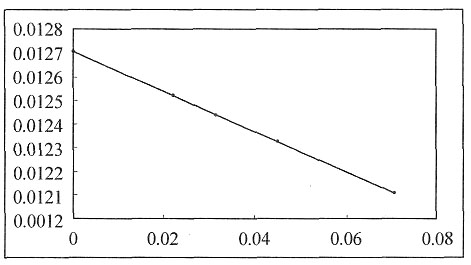
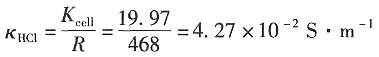
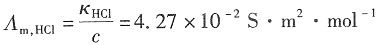
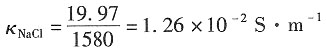
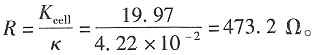
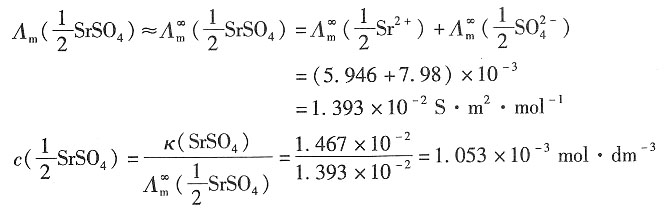
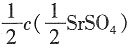 =5.266×10-4mol·dm-3。
=5.266×10-4mol·dm-3。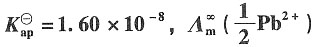 =7.0×10-3S·m2·mol-1,
=7.0×10-3S·m2·mol-1,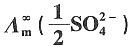 =7.98×10-3S·m2·mol-1。
=7.98×10-3S·m2·mol-1。
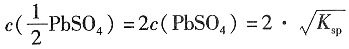 =2×1.26×10-4=2.53×10-4mol·dm-3
=2×1.26×10-4=2.53×10-4mol·dm-3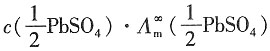 =2.53×10-4×1.5×10-2=3.8×10-3S·m-1
=2.53×10-4×1.5×10-2=3.8×10-3S·m-1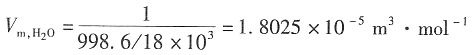
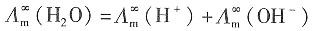 =3.498×10-2+1.98×10-2=5.478×10-2S·m2·mol-1。
=3.498×10-2+1.98×10-2=5.478×10-2S·m2·mol-1。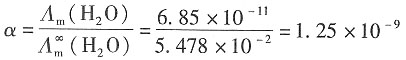
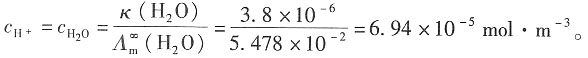
 。已知298K时,纯水的电导率为κ(H2O)=5.5×10-6S·m-1,
。已知298K时,纯水的电导率为κ(H2O)=5.5×10-6S·m-1,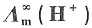 =3.498×10-2S·m2·mol-1,
=3.498×10-2S·m2·mol-1,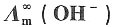 =1.98×10-2S·m2·mol-1,水的密度为997.09kg·m-3。
=1.98×10-2S·m2·mol-1,水的密度为997.09kg·m-3。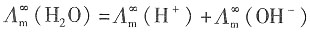 =3.498×10-2+1.98×10-2=5.478×10-2S·m2·mol-1
=3.498×10-2+1.98×10-2=5.478×10-2S·m2·mol-1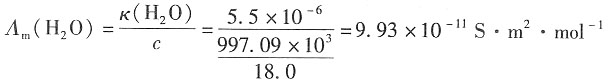
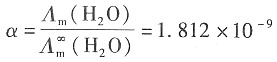
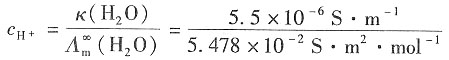 =1.004×10-4mol·m3=1.004×10-7mol·dm-3
=1.004×10-4mol·m3=1.004×10-7mol·dm-3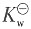 =(cH+)2=(1.004×10-7)2mol·dm-3=1.008×10-14mol·dm-3。
=(cH+)2=(1.004×10-7)2mol·dm-3=1.008×10-14mol·dm-3。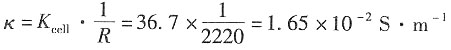
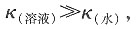 故κ(溶液)≈κCH3COOH,则有
故κ(溶液)≈κCH3COOH,则有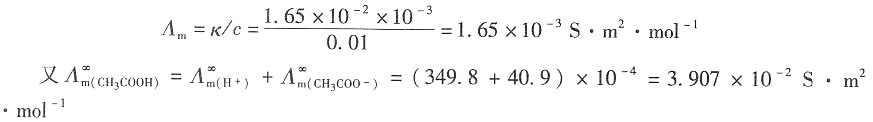


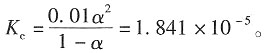

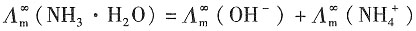 =1.98×10-7+73.4×10-4=2.741×10-2S-1·m2·mol-1
=1.98×10-7+73.4×10-4=2.741×10-2S-1·m2·mol-1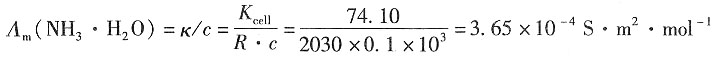
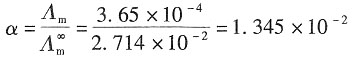
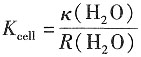
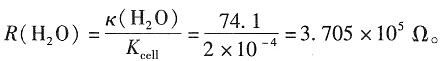
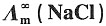 =1.086×10-2S·m2·mol-1,
=1.086×10-2S·m2·mol-1,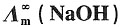 =2.172×10-2S·m2·mol-1和
=2.172×10-2S·m2·mol-1和 =1.298×10-2S·m2·mol-1;又已知NH3·H2O在浓度为0.1mol·dm-3时的摩尔电导率Λm=3.09×10-4S·m2·mol-1,浓度为0.01mol·dm-3时的摩尔电导率为Λm=9.62×10-4S·m2·mol-1。试根据上述数据求NH3·H2O的两种不同浓度溶液的解离度和解离常数。
=1.298×10-2S·m2·mol-1;又已知NH3·H2O在浓度为0.1mol·dm-3时的摩尔电导率Λm=3.09×10-4S·m2·mol-1,浓度为0.01mol·dm-3时的摩尔电导率为Λm=9.62×10-4S·m2·mol-1。试根据上述数据求NH3·H2O的两种不同浓度溶液的解离度和解离常数。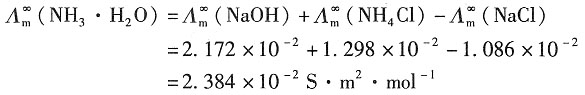
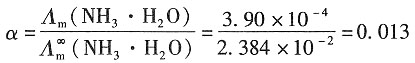

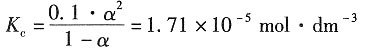
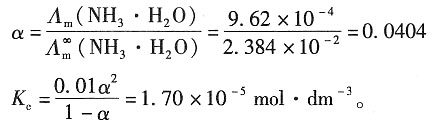
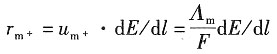
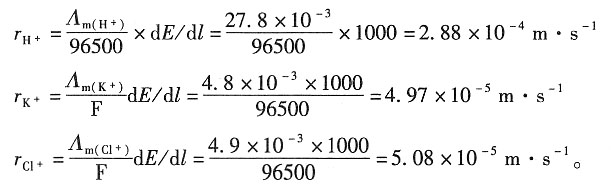
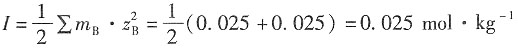
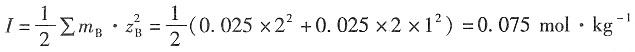
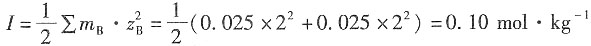
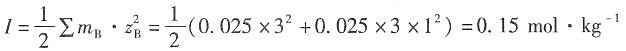

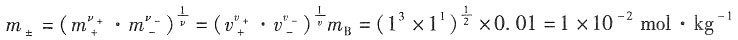
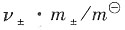 =0.904×1×10-2mol·kg-1/1mol·kg-1=9.04×10-3
=0.904×1×10-2mol·kg-1/1mol·kg-1=9.04×10-3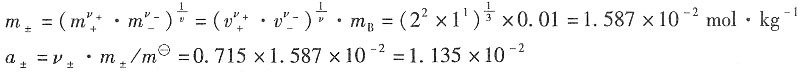
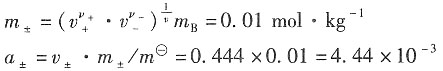
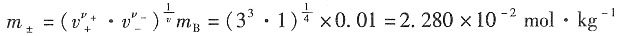
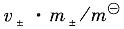 =0.571×2.28×10-2=1.302×10-2
=0.571×2.28×10-2=1.302×10-2 ×0.025×(1+1)=0.025mol·kg-1
×0.025×(1+1)=0.025mol·kg-1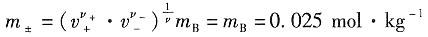
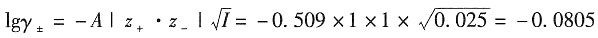
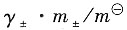 =0.831×0.025=0.0208
=0.831×0.025=0.0208
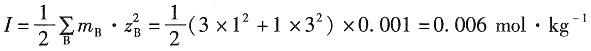
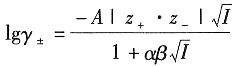
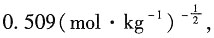 离子半径与β的积近似为1,所以有
离子半径与β的积近似为1,所以有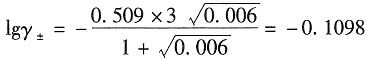
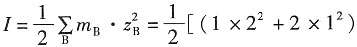 ×0.002+(1×22+1×22)×0.002]=0.014mol·kg-1
×0.002+(1×22+1×22)×0.002]=0.014mol·kg-1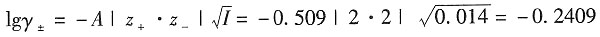
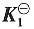 =4.31×10-7。试求CO2(g)饱和水溶液的浓度。已知
=4.31×10-7。试求CO2(g)饱和水溶液的浓度。已知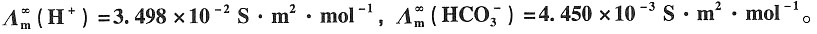
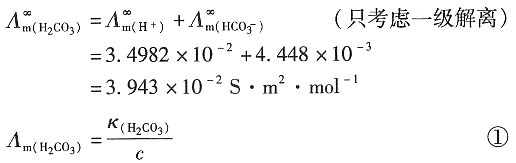

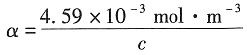

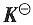 =1.8×10-5,试计算在下列不同情况下醋酸在浓度为1.0mol·kg-1时的解离度。
=1.8×10-5,试计算在下列不同情况下醋酸在浓度为1.0mol·kg-1时的解离度。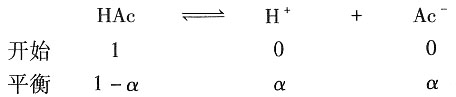
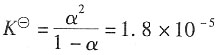
 =3.335×1-3~mol·kg-1
=3.335×1-3~mol·kg-1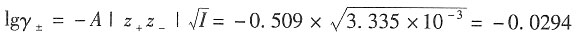

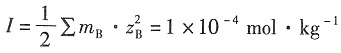
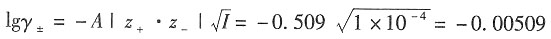
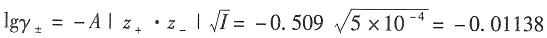
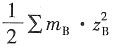 =3×10-4mol·kg-1
=3×10-4mol·kg-1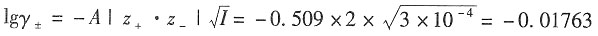
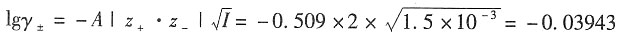
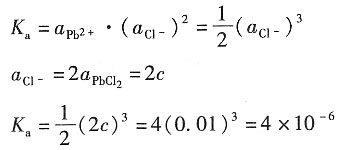
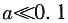
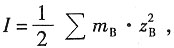 所以有
所以有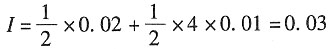
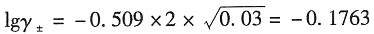
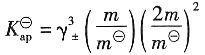 =0.6663×0.01×(2×0.01)2=1.182×10-6
=0.6663×0.01×(2×0.01)2=1.182×10-6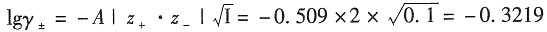
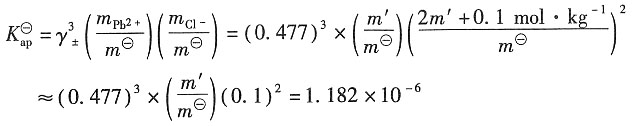
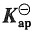 =a+·a-=5.77×10-5(计算中可作合理的近似)。
=a+·a-=5.77×10-5(计算中可作合理的近似)。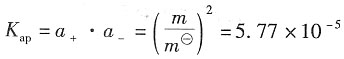
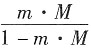 ≈m·M=7.6×10-3×235.8×10-3=1.79×10-3。
≈m·M=7.6×10-3×235.8×10-3=1.79×10-3。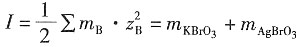
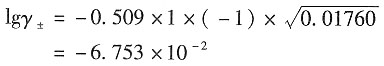
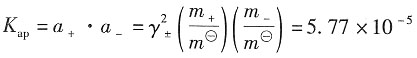
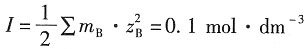
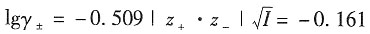
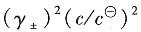 =1×10-8
=1×10-8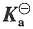 。
。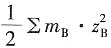 =mHNO3+mAgA=1×10-3+1.3×10-4=1.13×10-3mol·dm-3
=mHNO3+mAgA=1×10-3+1.3×10-4=1.13×10-3mol·dm-3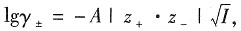 解得γ±=0.961
解得γ±=0.961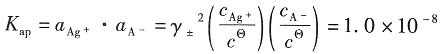

 =(61.92+78.4)×10-4S·m2·mol-1=1.403×10-2S·m2·mol-1
=(61.92+78.4)×10-4S·m2·mol-1=1.403×10-2S·m2·mol-1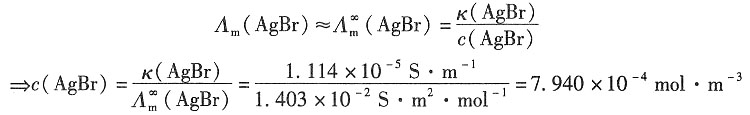
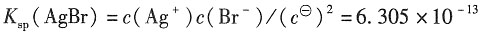
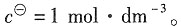
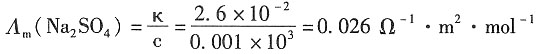
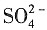 和CaSO4的摩尔电导率分别为:
和CaSO4的摩尔电导率分别为: =Λm(Na2SO4)-2λm(Na+)=0.016-2×5.0×10-3=0.016Ω-1·m2·mol-1
=Λm(Na2SO4)-2λm(Na+)=0.016-2×5.0×10-3=0.016Ω-1·m2·mol-1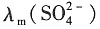 +λm(Ca2+)=0.016+2×6.0×10-3=0.028Ω-1·m2·mol-1
+λm(Ca2+)=0.016+2×6.0×10-3=0.028Ω-1·m2·mol-1