一、单选题4. 在苯氯化生产氯苯的过程中,已知氯化塔每小时生产纯氯苯800kg,从氯化塔出来的氯化液的组成为C
6H
668%(质量分数,下同)、C
6H
5Cl30%、C
6H
4Cl
21.5%、HCl0.5%。操作温度为82℃,进料苯的纯度为100%、氯气的纯度为95%(体积分数)。假定氯气全部参与反应,则排出气体的质量为______。
- A.278.07kg
- B.294.67kg
- C.291.40kg
- D.308.00kg
A B C D
A
[解析] 解:取物料计算基准为1h。
反应方程式:
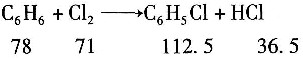
副反应:
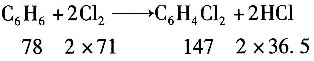
(1)氯化液质量的计算。
已知氯化液中含800kg氯苯,质量分数为30%。所以氯化液的质量为
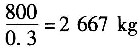
氯化液中除氯苯外,其他组分的质量为
C
6H
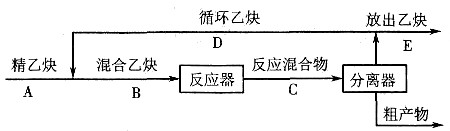
6:2667×0.68=1813.3kg
C
6H
4C
12:2667×0.015=40kg
HCl:2667×0.005=13.33kg
(2)参与氯化反应的物料的计算。
反应的苯的量(主反应和副反应消耗苯的量)为
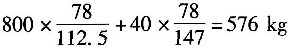
消耗Cl
2的量为
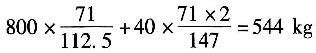
生成:HCl的量为
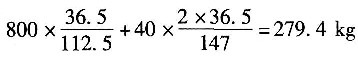
(3)加料量的计算。
加入苯的量为:1813.3+576=2389kg
把氯气的体积分数换算成质量分数(假定氯气中的惰性气体为空气,平均相对分子质量为29),即
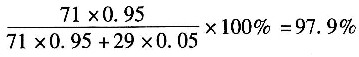
加入的氯气量为

其中惰性气体为556-544=12kg。
(4)排出气体质量的计算
排出气体的质量为
279.4-13.33+12=278.07kg
5. 硫酸铝可由含Al
2O
3的混合物与H
2SO
4反应制得。反应方程如下:

Al
2O
3的混合物中含杂质44.6%(质量分数,下同),原料硫酸为80%,的H
2SO
4,其余为H
2O。用1100kg Al
2O
3、2510kg80%的H
2SO
4,则过量的一种原料的转化率是______。假定Al
2O
3,全部转化。
- A.70.42%
- B.87.4%
- C.69.96%
- D.29.13%
A B C D
B
[解析] 解:按反应方程和已知条件计算如下。
Al
2O
3相对分子质量为102,Al
2(SO
4)
3相对分子质量为342,H
2SO
4相对分子质量为98。
加入硫酸(80%)量为2510kg,含纯H
2SO
4量为
2510×0.8=2008kg=20.49kmol
加入原料Al
2O
3混合物1100kg,含纯Al
2O
3量为
1100×0.554=609.4kg=5.97kmol
参加反应的H
2SO
4量应为5.97×3=17.91kmol。
在反应系统中H
2SO
4过量,过量20.49-17.91=2.58kmol
H
2SO
4转化率为
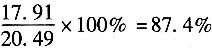
。
6. 在利用硫化矿提炼锌时,硫酸是副产物。该矿中含ZnS65%(质量分数,下同),其他35%为惰性物质。生产过程如反应方程所示,最后可以得到98%的硫酸,硫的回收率为99%,每天处理硫化矿186t。
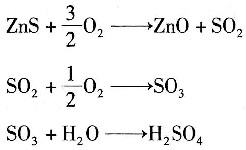
则每天需要水的量是______。
- A.24.67t
- B.22.2t
- C.2.47t
- D.24.92t
A B C D
A
[解析] 解:根据反应方程可知,当1mol的ZnS反应时,就可以产生1mol的H
2SO
4,即可以产生98%的H
2SO
4100g。
根据题意硫的回收率为99%,再进行计算。
(1)每天处理186t矿石,则内含ZnS量为
186×1000×0.65=120900kg
实际反应能得到硫酸的ZnS量为120900×0.99=119691kg
119691kg ZnS为1233.9kmol,即可生成1233.9kmol H
2SO
4,质量为120922.2kg,可以得到
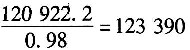
kg 98%的硫酸。
(2)用水量计算:吸收SO
3形成H
2SO
4的用水量为1233.9×18=22.2t,形成98%的H
2SO
4的用水量为123390-120922.2=2.47t。
每天消耗水量为22.2+2.47=24.67t。
7. 在硫酸生产过程中,二氧化硫催化氧化为三氧化硫。初始气体组成(体积分数)为SO
211%,O
210%,N
279%,氧化过程在570℃,120kPa下进行,转化率为70%。则反应混合物气体中SO
3的分压为______。
- A.9.6kPa
- B.10.01kPa
- C.9.24kPa
- D.53.87kPa
A B C D
A
[解析] 解:SO
2氧化反应方程式为
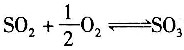
设原料气为100mol。
根据题意,进料气中SO
2为11mol,O
2为10mol,N
2为79mol。
反应后气体
SO
3=11×0.7=7.7mol
SO
2=11-7.7=3.3mol
O
2=10-0.5×11×0.7=6.15mol
N
2=79mol
反应后总摩尔数为96.15mol,其中
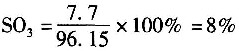
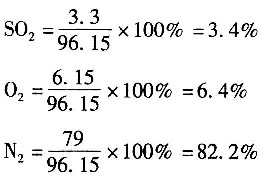
各组分的分压:
p
SO3=0.08×120=9.6kPa
p
SO2=0.034×120=4.08kPa
p
O2=0.064×120=7.68kPa
9. 将78%(质量分数,下同)的H
2SO
4加到水中配制成25%的H
2SO
4,配制1000kg25%的H
2SO
4放出的热量为______。
已知:78%的H
2SO
4积分溶解热为37656J/mol H
2SO
4,25%的H
2SO
4积分溶解热为69454.4J/mol H
2SO
4。
- A.8.1×107kJ
- B.8.1×104kJ
- C.8.1×102kJ
- D.81kJ
A B C D
B
[解析] 解:1000kg25%的H
2SO
4含溶质H
2SO
4 250kg,则
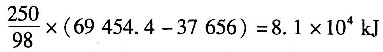
10. 甲醇脱氢生成甲醛的反应方程式为
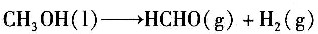
试用燃烧热数据计算0.1013MPa、25℃下的反应热。
25℃下甲醇(1)的燃烧热
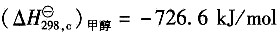
;
25℃下HCHO(g)的燃烧热
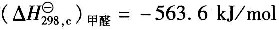
;
25℃下H
2(g)的燃烧热
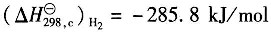
。
- A.-122.8kJ/mol
- B.-1576kJ/mol
- C.122.8kJ/mol
- D.-1290.2kJ/mol
A B C D
C
[解析] 解:0.1013MPa、25℃下的反应热为
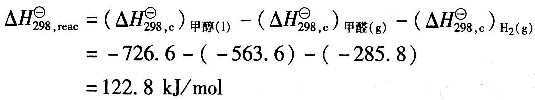
12. 如用98%的硫酸、98%的硝酸和70%的硫酸配制1000kg组成为含硫酸51%、含硝酸44%、含水5%的混合酸配酸过程,已知原料酸及混合酸的微分溶解热分别为:98%的H
2SO
4707.1kJ/kg,98%的HNO
3447.6kJ/kg,70%的H
2SO
4 257.3kJ/kg,混合酸506.26kJ/kg。则酸的配制过程混合热为______。
- A.3.5×105kJ
- B.3.6×104kJ
- C.2.7×104kJ
- D.2.7×105kJ
A B C D
B
[解析] 解:混合热QS=444×707.1+449×447.6+107×257.3-1000×506.26
=3.62×104kJ
14. 某溶液中含有1000kg水和100kg硫酸钠(分子量=142)。将该溶液冷却到10℃,此时溶解度为9kg无水盐/100kg水,所得结晶盐为Na
2SO
4·10H
2O。假设冷却过程中蒸发掉2%的水,结晶产品量为______。
- A.40.2kg
- B.33.2kg
- C.30.1kg
- D.35.5kg
A B C D
C
[解析] 解:对该系统进行物料衡算:
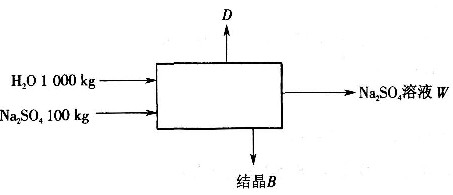
1100=D+W+B (1)
对Na
2SO
4进行衡算:
100=X
WW+X
BB (2)
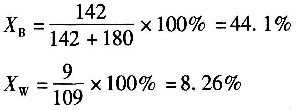
D=1000×2%=20
联立式(1)和式(2)求解得
B=30.1
W=1049.9
19. 某工厂燃料煤含水分3.3%,挥发物24.8%,固定碳60.3%,灰分11.6%。燃烧后由炉栅落下炉渣,用水来润湿以免灰尘飞扬,润湿后的炉渣中含水分34.5%,挥发物4.7%及固定碳18.2%,余下的均为灰分,则挥发物和固定碳的损失率为______。
- A.7.33%
- B.5.82%
- C.1.50%
- D.10.35%
A B C D
A
[解析] 解:取基准为100kg煤,燃烧得炉渣x kg。本题以灰分作为联系物,对灰分进行衡算:
0.426x=100×0.116=11.6
x=27.23kg
炉渣中可燃物(包括挥发物和固定碳)为
27.23×(0.047+0.182)=6.24kg
原煤中含可燃物24.8+60.3=85.1kg。
在炉渣中损失的可燃物为
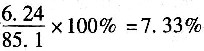
。
22. 用邻二甲苯催化氧化生产邻苯二甲酸酐。邻二甲苯投料量为210kg/h,空气量为4620m
3/h(标准状态),反应器出口组成(摩尔分数)为:苯酐0.654%、顺酐0.066%、邻二甲苯0.03%、氧16.53%、氮77.75%,还有H
2O、CO
2、CO等。试计算邻苯二甲酸酐(苯酐)的收率及选择性______。
反应式:
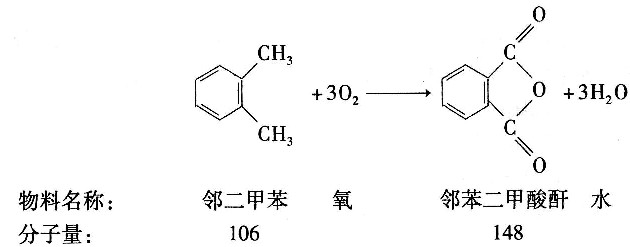
- A.苯酐的收率为69.15%,选择性为71.4%
- B.苯酐的收率为69.15%,选择性为96.9%
- C.苯酐的收率为96.9%,选择性为100%
- D.苯酐的收率为65.6%,选择性为71.4%
A B C D
A
[解析] 解:取计算基准为210kg/h邻二甲苯。
(1)输入N
2的量为:
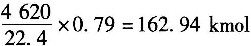
。
(2)出口物总量为:
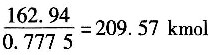
。
(3)得到苯酐的量为:209.56×0.00654=1.37kmol。
(4)出口物中邻二甲苯的量为:209.56×0.0003=0.063kmol。
邻二甲苯的转化率为
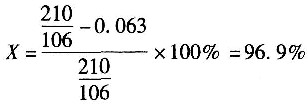
(5)邻苯二甲酸酐的收率为
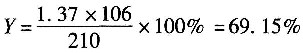
(6)邻苯二甲酸酐的选择性为
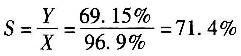
23. 有一蒸馏塔,输入物料为A、B、C的混合物,进入量为100kg/h,其组成中A占20%,B占30%,塔顶馏出物P中A组分的量为进料中A组分量的98.7%,塔釜液W中A占0.005,B占0.055,C占0.94,求塔顶和塔釜的产量(kg/h)及塔顶馏出物中A的百分数______。
- A.P=48kg,W=52kg,x=41.13%
- B.P=52kg,W=48kg,x=37.96%
- C.P=48kg,W=52kg,x=37.96%
- D.P=48kg,W=52kg,x=2.33%
A B C D
A
[解析] 解:取100kg输入物料为计算基准。
令x=馏出物中A的百分含量,y=馏出物中B的百分含量。
根据题意,已知输入物料中A组分的98.7%自塔顶蒸出,即流股P中A组分的量为
Px=100×20%×98.7%=19.74kg (1)
A组分衡算式:
100×20%=W×0.5%+19.74 (2)
总物料衡算式:
100=P+W (3)
B组分衡算式:
100×30%=W×5.5%+Py (4)
由式(2)得W=52kg,代入式(3)得P=100-52=48kg,代入式(4)得y=56.54%。
由式(1)得
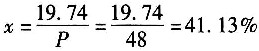
25. 在含苯38%(质量分数,下同)和甲苯62%的混合液连续精馏过程中,要求馏出物中能回收原料中97%的苯,釜残液中含苯不高于2%。进料流量为20000kg/h,则塔顶苯的摩尔分数近似比为______。
A B C D
B
[解析] 解:以进塔苯和甲苯的混合物每小时20000kg为基准。
设进料量为F,塔顶液量为D,塔釜液量为W。以下标B代表苯。
进料中苯的摩尔分数
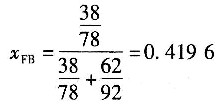
釜残液中苯的摩尔分数
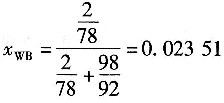
进料液的平均分子质量
=0.4196×78+(1-0.4196)×92=86.13
进塔物料的摩尔流量
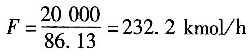
依题意,馏出液中能回收原料中97%的苯,所以

作全塔苯的质量衡算:
Fx
FB=Dx
DB+Wx
WB 作全塔总质量衡算:
F=W+D
将已知数据代入上述质量衡算方程得
232.2×0.4196=94.51+0.02351W (A)
232.2=W+D (B)
由式(A)得W=124.25kmol/h,由式(B)得D=107.95kmol/h。
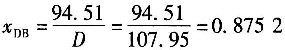
27. 乙烯在银催化剂上用过量空气部分氧化制取环氧乙烷。反应方程如下。
主反应:
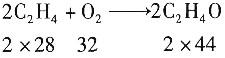
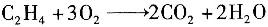
副反应:
反应器进口混合气体的流量为45000m
3(标准),组成如下表所示。
| 物料组成 |
| 物料组成 | C2H4 | N2 | O2 | 合计 |
| 摩尔分数/% | 3.5 | 82.0 | 14.5 | 100.0 |
乙烯的转化率为32%,反应选择性为69%,则反应器出口气体的流量近似值为______。
- A.57107.5kg
- B.57415.2kg
- C.56981.95kg
- D.11289.9kg
A B C D
B
[解析] 解:取混合气体流量45000m
3为基准。
(1)计算反应器进口气体的平均分子量。
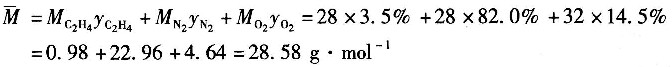
(2)计算反应器进、出口的质量流量。
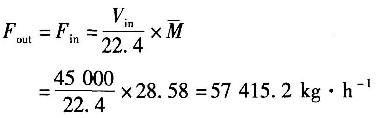
28. 有乙烯和丙烯的气体混合物,摩尔分数分别为80%和20%。已知乙烯和丙烯的C
p,m—T函数式如下。
乙烯:C
p,m1=2.830+28.601×10
-3T-8.726×10
-6T
2(kcal/(kmol·K)
丙烯:C
p,m2=2.253+45.116×10
-3T-13.740×10
-6T
2(kcal/(kmol·K)
则上述混合气体100℃时的定压摩尔热容C
p,m为______。
- A.6.01kJ/(kmol·K)
- B.57.53kJ/(kmol·K)
- C.50.3kJ/(kmol·K)
- D.55.51kJ/(kmol·K)
A B C D
D
[解析] 解:以Cp,m1和Cp,m2分别表示100℃时乙烯和丙烯的理想气体定压摩尔热容。
Cp,m1=2.830+28.601×10-3×373-8.726×10-6×3732=12.3kcal/(kmol·K)
=51.42kJ/(kmol·K)
Cp,m2=2.253+45.116×10-3×373-13.740×10-63732=17.2kcaL/(kmol·K)
=71.87kJ/(kmol·K)
Cp,m=0.8×51.42+0.2×71.87=55.51kJ/(kmol·K)
二、多选题7. 已知化学反应n
1A(g)+n
2B(g)→n
3C(g)+n
4D(g)中参与反应的物质在该相态下生成热和燃烧热分别为
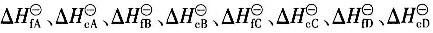
,则该反应的化学反应热计算公式正确的有______。
A.

B.
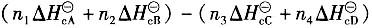
C.
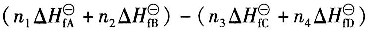
D.
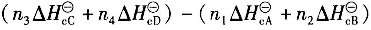
A B C D
19. 丙烷充分燃烧时供入空气量为理论量的125%,反应式为C
3H
8+5O
2=3CO
2+4H
2O,每产生1000mol燃烧产物所需的空气摩尔数错误的有______。(已知每mol空气中含O
2 0.21mol,含N
2 0.79mol)
- A.749.2mol
- B.937.0mol
- C.1686.6mol
- D.1324.7mol
A B C D
ACD
[解析] 解:取1mol丙烷为计算基准。
需要氧气:1.25×5=6.25mol;
需要空气:6.25/0.21=29.76mol。
燃烧产物量:O
2 1.25mol,N
2 29.76×0.79=23.51mol,H
2O 4 mol,CO
2 3mol,总计1.25+23.51+4+3=31.76mol。
每1000mol燃烧产物需要的空气量为:
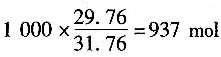
。
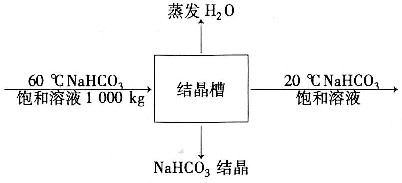
20. 一个结晶槽内装有60℃的NaHCO
3饱和溶液1000kg。将此溶液冷却至20℃,若在冷却过程中进料溶液的水有5%蒸发掉,则溶液中结晶出的NaHCO
3量不正确的有______。已知:NaHCO
3在20℃和60℃的水中溶解度分别为9.6g/100 g H
2O和16.4g/100g H
2O。
- A.54.66kg
- B.62.54kg
- C.67.66kg
- D.73.05kg
A B C D
ACD
[解析] 解:取60℃的NaHCO
3饱和溶液1000kg为基准。
设NaHCO
3结晶为x kg,20℃的NaHCO
3饱和溶液量为y kg。
(1)对NaHCO
3溶液浓度的表示方法进行换算。
20℃时NaHCO
3饱和溶液的浓度为:

。
60℃时NaHCO
3饱和溶液的浓度为:
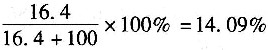
。
(2)进行物料计算。
对NaHCO
3进行衡算:1000×0.1409=x+0.0876y。
对H
2O进行衡算:1000×0.8591=1000×0.8591×0.05+0.9124y。
联立上述方程求解得x=62.54kg,y=894.5kg。
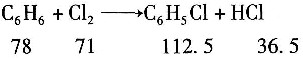
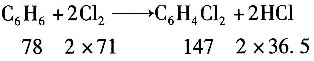
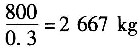
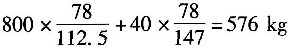
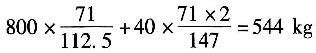
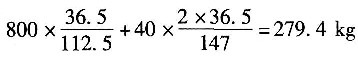
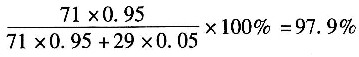

 Al2O3的混合物中含杂质44.6%(质量分数,下同),原料硫酸为80%,的H2SO4,其余为H2O。用1100kg Al2O3、2510kg80%的H2SO4,则过量的一种原料的转化率是______。假定Al2O3,全部转化。
Al2O3的混合物中含杂质44.6%(质量分数,下同),原料硫酸为80%,的H2SO4,其余为H2O。用1100kg Al2O3、2510kg80%的H2SO4,则过量的一种原料的转化率是______。假定Al2O3,全部转化。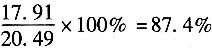 。
。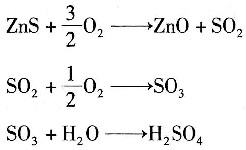
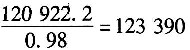 kg 98%的硫酸。
kg 98%的硫酸。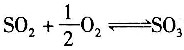
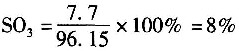
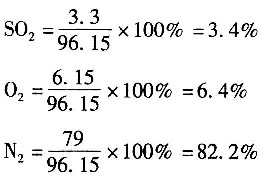
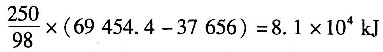
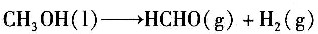 试用燃烧热数据计算0.1013MPa、25℃下的反应热。
试用燃烧热数据计算0.1013MPa、25℃下的反应热。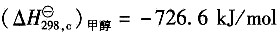 ;
;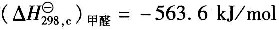 ;
;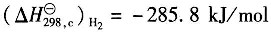 。
。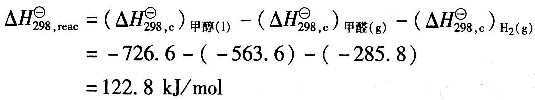
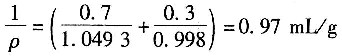

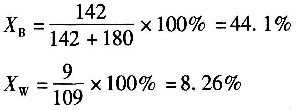
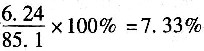 。
。

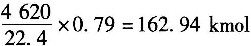 。
。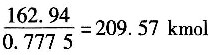 。
。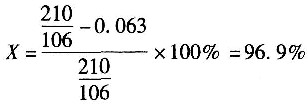
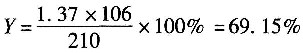
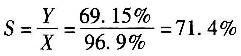
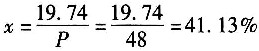
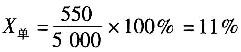
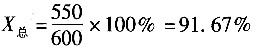
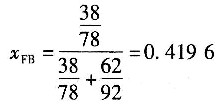
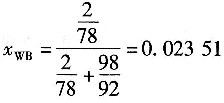
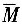 =0.4196×78+(1-0.4196)×92=86.13
=0.4196×78+(1-0.4196)×92=86.13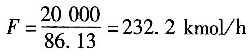

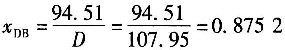
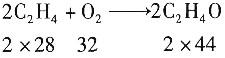

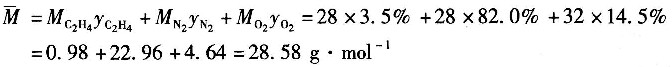
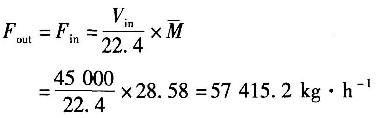

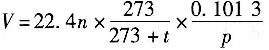
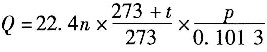
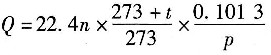
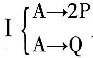 及反应
及反应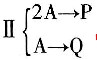 ,已知P为目的产物,P的收率为80%。当P的产量为1kmol时,上述两个反应所需要的A的量不正确的有______。
,已知P为目的产物,P的收率为80%。当P的产量为1kmol时,上述两个反应所需要的A的量不正确的有______。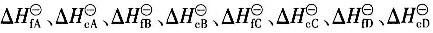 ,则该反应的化学反应热计算公式正确的有______。
,则该反应的化学反应热计算公式正确的有______。
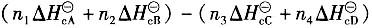
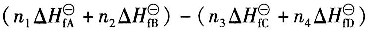
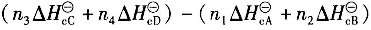
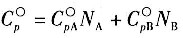
 计算
计算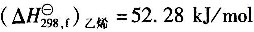 。
。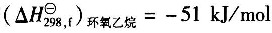 。
。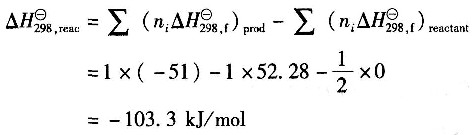
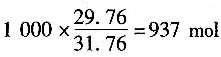 。
。
 。
。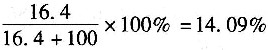 。
。