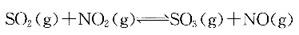
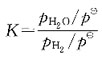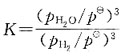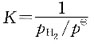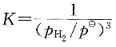单项选择题6. 已知
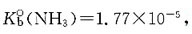
用广泛pH试纸测定0.10mol/dm
3氨水液的pH值约是:
A B C D
D
[解析] NH
3为一元弱碱,
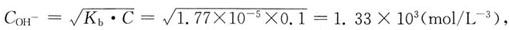
,C
H+=10
-14=C
OH-=7.52×10
-12,pH=-lgC
H+≈11。
9. 难溶电解质Aga在浓度为0.01mol/dm
3的下列溶液中,溶解度最小的是:
- A.NH3
- B.NaCl
- C.H2O
- D.Na2S2O2
A B C D
B
[解析] AgCl溶液中存在如下平衡:AgCl=Ag
++Cl
-,加入NH。和Na
2S
2O
3后,NH
3和
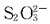
与Ag
+形成配离子,使平衡向右移动,AgCl溶解度增大;加入NaCl,溶液中Cl
-浓度增大,平衡向左移动,AgCl溶解度减小。
10. 25℃时,在[Cu(NH
3)
4]SO
4水溶液中,滴加BaCl
2溶液时有白色沉淀产生,滴加NaOH时无变化,而滴加Na
2S时则有黑色沉淀,以上现象说明该溶液中:
A.
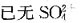
B.已无游离NH
3 C.已无Cu
2+ D.
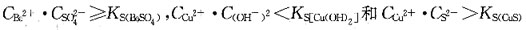
A B C D
D
[解析] 根据溶度积规则,滴加BaCl2有白色沉淀,则滴加NaOH无沉淀,滴加Na2S有黑色沉淀。
13. 将15.0g糖(C
6H
12O
6)溶于200g水中。该溶液的冰点(k
fp=1.86)是:
- A.-0.258℃
- B.-0.776℃
- C.-0.534℃
- D.-0.687℃
A B C D
B
[解析] 质量摩尔浓度为1000g溶剂中所含溶质的物质的量。所以糖的质量摩尔浓度
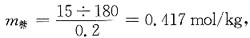
凝固点下降,ΔT
fp=K
fp·m
糖=1.86×0.417≈0.776℃,所以该溶液的冰点是-0.776℃。
17. 将1L4mol/L氨水和1L2mol/L盐酸溶液混合,混合后OH
-离子浓度为:
- A.1mol/L
- B.2mol/L
- C.8.0×10-6mol/L
- D.1.8×10-5mol/L
A B C D
D
[解析] K
bNH3·H2O=1.8×10
-5,混合后为

的碱性缓冲溶液,C
OH-=K
b·C
碱/C
盐。
23. 将0.2mol/L的醋酸与0.2mol/L醋酸钠溶液混合,为使溶液pH值维持在4.05,则酸和盐的比例应为(K
a=1.76×10
-5):
A B C D
C
[解析] 根据弱酸和共轭碱组成的缓冲溶液H
+浓度计算公式C
H+=K
a·C
酸/C
盐,则

24. 已知Ag
2SO
4的K
sp=1.2×10
-5,CaSO
4的K
sp=7.1×10
-5,BaSO
4的K
sp=1.07×10-
10。在含有浓度均为1moI/L的Ag
+、Ca
2+、Ba
2+的混合溶液中,逐滴加入H
2SO
4时,最先和最后沉淀的产物分别是:
- A.BaSO4和Ag2SO4
- B.BaSO4和CaSO4
- C.Ag2SO4和CaSO4
- D.CaSO4和Ag2SP4
A B C D
B
[解析] Ag
2SO
4的
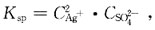
为使Ag
+沉淀生成Ag
2SO
4,所需
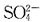
的最小浓度为:
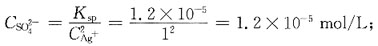
同理,为使Ca
2+沉淀生成CaSO
4所需
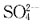
的最小浓度为:
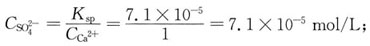
为使Ba
2+沉淀生成BaSO
4需
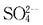
的最小浓度为:
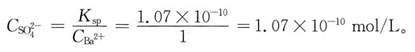
25. 已知CaCO
3和PbI
2的溶度积均约为1×10
-9,两者在水中的溶解度分别为S
1和S
2。下列二者的关系中正确的是哪一个?
- A.S1<S2
- B.2S1=S2
- C.S1>S2
- D.S1≈S2
A B C D
A
[解析] CaCO
3属于AB型,PbI
2属于AB
2型难溶电解质。其溶解度与溶度积之间的关系分别为:

27. bI
2的溶解度为1.52×10
-3mol/L,它的溶解积常数为:
- A.1.40×10-8
- B.3.50×10-7
- C.2.31×10-6
- D.2.80×10-8
A B C D
A
[解析] PbI
2为AB
2型,
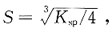
则K
sp=4S
3=4×(1.52×10
-3)
3≈1.40×10
-8。
30. 对一个化学反应来说,下列叙述正确的是:
A.
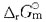
越小,反应速率越快
B.
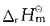
越小,反应速率越快
C.活化能越小,反应速率越快
D.活化能越大,反应速率越快
A B C D
C
[解析] 由阿仑尼乌斯公式
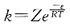
可知:温度一定时,活化能越小,速率常数就越大,反应速率也越大。活化能越小,反应越易正向进行。活化能越小,反应放热越大。
36. 为了减少汽车尾气中NO和CO污染大气,拟按下列反应进行催化转化
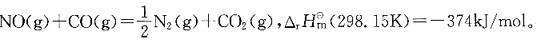
为提高转化率,应采取的措施是:
A B C D
A
[解析] 压力对固相或液相的平衡没有影响,对反应前后气体计量数不变的反应的平衡也没有影响。对于反应前后气体计量系数不同的反应,增大压力,平衡向气体分子数减少的方向移动;减少压力,平衡向气体分子数增加的方向移动。
温度对化学平衡影响,是通过
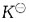
值改变,从而使平衡发生移动。对于吸热反应,温度T升高,
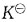
值增大,平衡正向运动;对于放热反应,温度T升高,
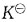
降低,平衡逆向移动。
此反应为气体分子数减少的反应,所以增加压力平衡正向移动;此反应还是放热反应,降低温度平衡正向移动。
38. 反应
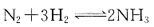
的平均速率,在下面的表示方法中不正确的是?
A.
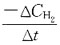
B.
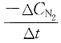
C.
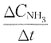
D.
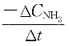
A B C D
D
[解析] 反应速率通常由单位时间内反应物或生成物的变化量来表示。
41. 某反应的速率方程为
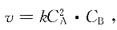
若使密闭的反应容积减小一半,则反应速率为原来速率的多少?
A.
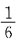
B.
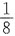
C.8
D.
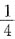
A B C D
C
[解析] 反应容积减小一半,相当于反应物浓度增加到原来的两倍。反应速率v=k(2CA)2·(2CB)=8kC2A·CB。
50. 有反应:

此反应的标准平衡常数表达式应是:
A.
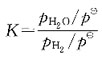
B.
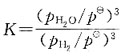
C.
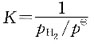
D.
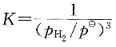
A B C D
D
[解析] 纯固体、纯液体的浓度不写入平衡常数表达式中;反应式中物质前的计量数是平衡常数表达式中浓度的指数。
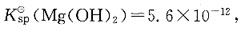 则Mg(OH)2在0.01mol·L-1NaOH溶液中的溶解度为:
则Mg(OH)2在0.01mol·L-1NaOH溶液中的溶解度为: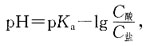 溶液稀释pH值不变。
溶液稀释pH值不变。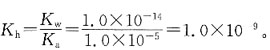
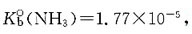 用广泛pH试纸测定0.10mol/dm3氨水液的pH值约是:
用广泛pH试纸测定0.10mol/dm3氨水液的pH值约是: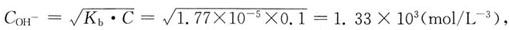 ,CH+=10-14=COH-=7.52×10-12,pH=-lgCH+≈11。
,CH+=10-14=COH-=7.52×10-12,pH=-lgCH+≈11。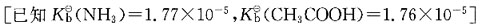
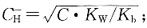 选项D的氢离子浓度计算公式
选项D的氢离子浓度计算公式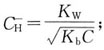 选项C的氢离子浓度计算公式
选项C的氢离子浓度计算公式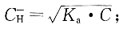 选项。的氢离子浓度计算公式
选项。的氢离子浓度计算公式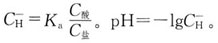
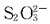 与Ag+形成配离子,使平衡向右移动,AgCl溶解度增大;加入NaCl,溶液中Cl-浓度增大,平衡向左移动,AgCl溶解度减小。
与Ag+形成配离子,使平衡向右移动,AgCl溶解度增大;加入NaCl,溶液中Cl-浓度增大,平衡向左移动,AgCl溶解度减小。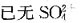
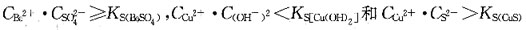
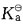 是:
是: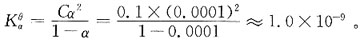
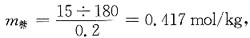 凝固点下降,ΔTfp=Kfp·m糖=1.86×0.417≈0.776℃,所以该溶液的冰点是-0.776℃。
凝固点下降,ΔTfp=Kfp·m糖=1.86×0.417≈0.776℃,所以该溶液的冰点是-0.776℃。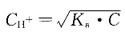
 的碱性缓冲溶液,COH-=Kb·C碱/C盐。
的碱性缓冲溶液,COH-=Kb·C碱/C盐。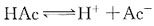 平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关:
平衡。当加入少量酸或碱时,均可使平衡移动。电离度与浓度有关: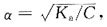 即C↓,α↓;C↓,α↓。
即C↓,α↓;C↓,α↓。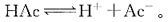 为使电离度增加,必须使平衡向右移动;为使pH值增加,必须使H+。离子浓度下降。
为使电离度增加,必须使平衡向右移动;为使pH值增加,必须使H+。离子浓度下降。
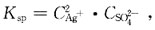 为使Ag+沉淀生成Ag2SO4,所需
为使Ag+沉淀生成Ag2SO4,所需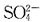 的最小浓度为:
的最小浓度为: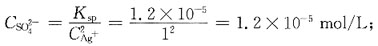
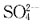 的最小浓度为:
的最小浓度为: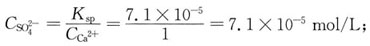
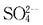 的最小浓度为:
的最小浓度为: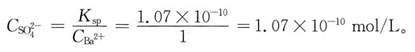

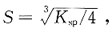 则Ksp=4S3=4×(1.52×10-3)3≈1.40×10-8。
则Ksp=4S3=4×(1.52×10-3)3≈1.40×10-8。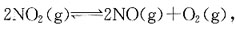 恒温条件下达到平衡后,加一定量Ar气体保持总压力不变,平衡将会:
恒温条件下达到平衡后,加一定量Ar气体保持总压力不变,平衡将会: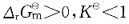
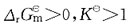
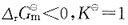
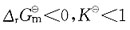

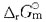 越小,反应速率越快
越小,反应速率越快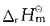 越小,反应速率越快
越小,反应速率越快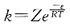 可知:温度一定时,活化能越小,速率常数就越大,反应速率也越大。活化能越小,反应越易正向进行。活化能越小,反应放热越大。
可知:温度一定时,活化能越小,速率常数就越大,反应速率也越大。活化能越小,反应越易正向进行。活化能越小,反应放热越大。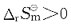 的是:
的是: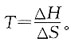
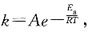 A指前因子;E为反应的活化能。A与Ea都是反应的特性常数,基本与温度无关。
A指前因子;E为反应的活化能。A与Ea都是反应的特性常数,基本与温度无关。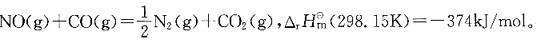 为提高转化率,应采取的措施是:
为提高转化率,应采取的措施是: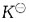 值改变,从而使平衡发生移动。对于吸热反应,温度T升高,
值改变,从而使平衡发生移动。对于吸热反应,温度T升高,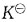 值增大,平衡正向运动;对于放热反应,温度T升高,
值增大,平衡正向运动;对于放热反应,温度T升高,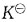 降低,平衡逆向移动。
降低,平衡逆向移动。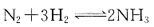 的平均速率,在下面的表示方法中不正确的是?
的平均速率,在下面的表示方法中不正确的是?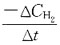
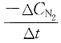
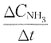
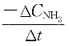
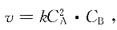 若使密闭的反应容积减小一半,则反应速率为原来速率的多少?
若使密闭的反应容积减小一半,则反应速率为原来速率的多少?
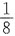
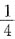
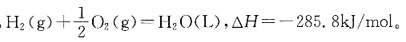 若温度升高,则有下列中何种变化?
若温度升高,则有下列中何种变化?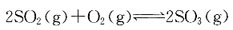 的ΔH<0。下面叙述中正确的是?
的ΔH<0。下面叙述中正确的是?
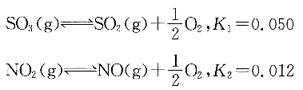
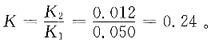
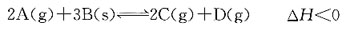
 此反应的标准平衡常数表达式应是:
此反应的标准平衡常数表达式应是: