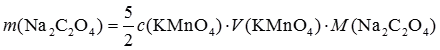一、单项选择题(下列每题给出的四个选项中,只有一个选项是符合题目要求的)1. 微溶化合物Ag
2CrO
4(K
sp
=1.12×10
-12)在0.0010mol·L
-1AgNO
3溶液中的溶解度为s
1,在0.0010mol·L
-1K
2CrO
4溶液中的溶解度为s
2,两者关系为______。
- A.s1>s2
- B.s1<s2
- C.s1=s2
- D.不确定
A B C D
B
[解析] 计算得
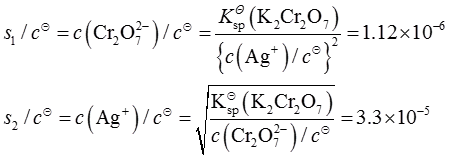
4. 已知反应A
⇌B在298K时,k
正=100k
逆,正逆反应活化能的关系为______。
- A.Ea正<Ea逆
- B.Ea正>Ea逆
- C.Ea正=Ea逆
- D.不确定
A B C D
A
[解析] 根据阿伦尼乌斯公式,

,温度相同时,反应速率越快,活化能越低。根据题意,在298K时,k
正=100k
逆,故正确答案为A。
7. 已知18℃时K
w
=6.4×10
-15,25℃时K
w
=1.0×10
-14,下列说法正确的是______。
- A.水的质子自递反应是放热过程
- B.在25℃时水的pH大于在18℃时的pH
- C.在18℃时,水中氢氧根离子的浓度是8.0×10-8mol·L-1
- D.水的质子自递反应是熵减反应
A B C D
C
[解析] AD两项,K

增大,反应为吸热过程,自发的吸热反应必为熵增反应;B项,一定温度下,纯水的pH=pK
w
/2;C项,纯水中
9. 配位滴定中,确定某金属离子能被EDTA准确滴定的最低pH(允许相对误差0.1%)的依据是______。
A.lgc
MK

′
MY≥5,lgα
Y(H)=lgK
 MY
MY-lgK
 ’MY
’MY B.lgc
MK
 MY
MY≥8,lgα
Y(H)=lgK
 ’MY
’MY-lgK
 MY
MY C.lgc
MK

′
MY≥6,lgα
Y(H)=lgK
 MY
MY-lgK
 ’MY
’MY D.lgc
MK
 MY
MY≥6,lgα
Y(H)=lgK
 ’MY
’MY-lgK
 MY
MY A B C D
C
[解析] 配位滴定中,金属离子能够被EDTA准确滴定的条件为:lgc
MK

′
MY≥6,lgα
Y(H)=lgK
 MY
MY-lgK
 ’MY
’MY。
10. 由电对Zn
2+/Zn与Cu
2+/Cu组成铜锌原电池。298K时,若Zn
2+和Cu
2+的浓度分别为1mol·L
-1和10
-8mol·L
-1,此时原电池的电动势比标准状态时的电动势______。
- A.下降0.48V
- B.上升0.48V
- C.下降0.24V
- D.上升0.24V
A B C D
C
[解析] 标准状态下,锌-铜原电池中,铜电极为正极,有
题中条件下,负极为标准锌电极,
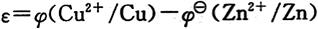
正极电极电势可依能斯特方程算得
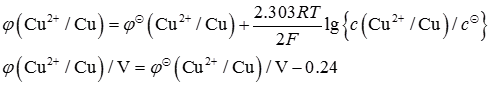
即正极电极电势比标准电极电势低0.24V,所以原电池电动势降低0.24V。
11. 已知298K时,反应
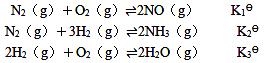
则反应4NH
3(g)+5O
2(g)
⇌4NO(g)+6H
2O(g)的K
4
为______。
A.(K
1
)
2·(K
3
)
3·(K
2
)
2 B.(K
1
)
2·(K
3
)
3/(K
2
)
2 C.2(K
1
)+3(K
3
)-2(K
2
)
2 D.(K
1
)
2/(K
3
)
3·(K
2
)
2 A B C D
B
[解析] 反应式4=2×反应式(1)+3×反应式(3)-2×反应式(2)。
13. 已知φ

(H
2O
2/H
2O)=1.78V,φ

(Fe
3+/Fe
2+)=0.77V,φ

(Cu
2+/Cu)=0.34V,φ

(Sn
4+/Sn
2+)=0.15V,下列各组物质在标准状态下能共存的是______。
- A.Fe3+,Cu
- B.Fe2+,Sn4+
- C.Sn2+,Fe3+
- D.H2O2,Fe2+
A B C D
B
[解析] 氧化还原反应发生的条件是:φ(氧化物质)>φ(还原物质)。
15. 298K定压条件下,1mol白磷和1mol红磷与足量的Cl
2(g)完全反应生成PCl
5(s)时,Δ
rH
m
分别为-447.1kJ·mol
-1和-429.5kJ·mol
-1,白磷和红磷的Δ
fH
m
(298K)分别为______。
- A.0kJ·mol-1,-17.6kJ·mol-1
- B.0kJ·mol-1,+17.6kJ·mol-1
- C.+17.6kJ·mol-1,0kJ·mol-1
- D.-17.6kJ·mol-1,0kJ·mol-1
A B C D
A
[解析] CD两项,化学热力学规定,参考状态的磷元素为白磷,而不是性质更稳定的红磷,所以
Δ
fH
m
{P(白磷)}=0
由已知条件知
(1)
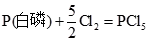
;Δ
rH
m
(1)=-447.1kJ·mol
-1 (2)
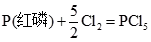
;Δ
rH
m
(2)=-429.5kJ·mol
-1 反应式(1)-反应式(2)得:P(白磷)=P(红磷)。根据物质的标准摩尔生成焓定义知,该反应的标准摩尔焓变等于红磷的标准摩尔生成焓:
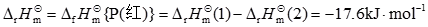
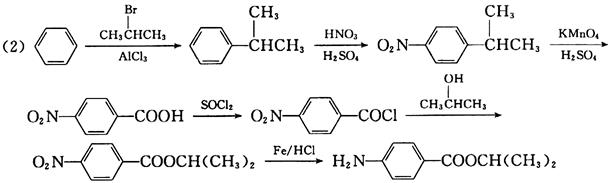
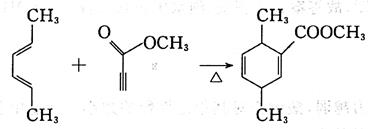
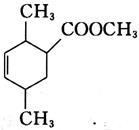
18. 制备化合物
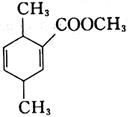
的反应原料为______。
A.

B.
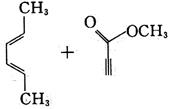
C.
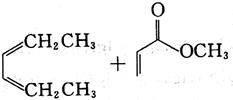
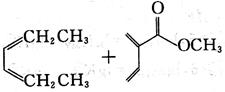
D.
A B C D
B
[解析] B项,用双烯合成反应环状非共轭二烯烃,可用共轭二烯烃与炔烃加热得到:
A项,反应得到
C项,反应加热下无反应;D项,反应使用的单烯烃双键上没有吸电子基,二烯烃双键上倒连有吸电子基,反应很难进行,也得不到目标产物。
24. 下列化合物与金属钠反应的速率由大到小的顺序是______。
(1)H
2O (2)CH
3CH
2OH (3)(CH
3)
3COH
- A.(1)>(2)>(3)
- B.(3)>(2)>(1)
- C.(3)>(1)>(2)
- D.(2)>(3)>(1)
A B C D
A
[解析] 一般与金属钠反应生成氢气的反应与化合物的酸性及水溶性相关,都是水溶性的醇,伯醇酸性略强于叔醇,水的酸性强于醇。
26. 下列化合物中与AgNO
3/乙醇溶液反应,速率由大到小的顺序为______。
(1)CH
3CH
2CH
2CH
2Br
(2)CH
3CH
2CHBrCH
3 (3)CH
3CH=CHCH
2Br
- A.(2)>(3)>(1)
- B.(3)>(2)>(1)
- C.(1)>(3)>(2)
- D.(3)>(1)>(2)
A B C D
二、填空题1. 工业上利用反应2H
2S(g)+SO
2(g)=3S(g)+2H
2O(g)除去废气中的剧毒气体H
2S,此反应为______反应(填“吸热”或“放热”)。
放热
[解析] 该自发反应为气体物质的量减少,即熵减的反应,故定放热。
2. 某元素的原子序数比氪小,当它失去三个电子后,最外层l=2的轨道内电子为半充满状态,则该元素的基态原子核外电子排列式为______。
1s22s22p63s23p63d64s2
[解析] l=2的轨道为d轨道,又因其原子序数小于氪,所以该元素必位于第四周期。
3. 在酸性介质中,氧电极的标准电极电势φ

(O
2/H
2O)=1.23V,则在p(O
2)=100kPa和pH=14.00的条件下,φ(O
2/H
2O)等于______V。
40
[解析] 4H
+(aq)+O
2(g)+4e
-⇌2H
2O(l)
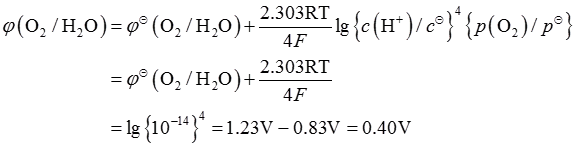
4. 要使乙二醇水溶液的凝固点为-12℃,须向100g水中加入乙二醇______g。已知:K
f(H
2O)=1.86K·kg·mol
-1,M(C
2H
6O
2)=62.08g·mol
-1。
40
[解析]
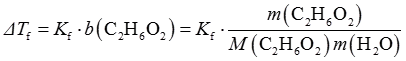
计算得m(C
2H
6O
2)≈40g。
5. [Co(NH
3)
2(H
2O)
4]Cl
3的系统命名为______。
氯化二氨·四水合钴(Ⅲ)
[解析] 本题考查配合物的命名方法:阳离子在前,阴离子在后;内界命名顺序为:配位体个数—配位体名称—合—中心离子(氧化值)。
6. 在OF
2分子中,O原子以______杂化轨道与F原子成键,分子的空间构型为______。
sp3不等性,V型
[解析] O原子sp3不等性杂化形成四个杂化轨道,2个与F原子成键,2个被孤对电子占据,分子构型为V型。
7. 在[Ag(CN)
2]
-、[FeF
6]
3-、[Fe(CN)
6]
4-和[Cu(NH
3)
4]
2+四种配离子中,属于内轨型的配离子有______和______。
[Fe(CN)6]4-;[Cu(NH3)4]2+
[解析] 外轨型配合物是指中心原子外层空轨道与配合体形成的配合物;内轨型配合物是指中心原子次外层轨道与配合体形成的配合物。
8. 直接电势法测定溶液的pH时,常用的参比电极可选用______,指示电极可选用______。
饱和甘汞电极;pH玻璃电极
[解析] 直接电势法测pH选择饱和甘汞电极、pH玻璃电极作为参比电极和指示电极。
9. 下列各电极中,φ

最大的是______,最小的是______。
①φ

(Ag
+/Ag)
②φ

(AgBr/Ag)
③φ

(AgI/Ag)
④φ

(AgCl/Ag)
①;③
[解析] 电极大小以电对氧化物质转化为还原物质的难易程度来评判。
10. 缓冲溶液缓冲容量的大小取决于缓冲系统共轭酸碱对的______和______。
浓度;浓度比
[解析] 根据缓冲容量与溶液浓度的关系
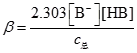
,缓冲容量与总浓度有关。当C(HB):C(B
-)=1:1时,缓冲容量最大,因此缓冲容量与共轭酸碱对的浓度比相关。
11. 苯胺、环己胺、N-甲基环己胺碱性由强到弱的顺序是______。
N-甲基环己胺>环己胺>苯胺
[解析] N-甲基环己胺具有推电子基,氮原子具有更高的电子云密度,而苯胺由于共轭效应,氮原子电子云密度较低,电子云密度的大小决定了胺类物质碱性的强弱。
12. 完成反应式(只写主产物):
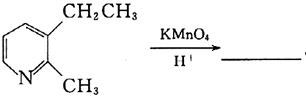
[解析] 苯环上连有烷基时,在酸性高锰酸钾条件下,烷基被氧化为羧基。
13. 化合物
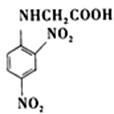
可由
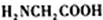
和______反应生成。
14. HC≡CCH
2CH=CH
2和HBr等摩尔反应的产物的结构式为______。
[解析] HCCCH2CH=CH2分子中含有双键和三键,和HBr发生加成反应,氢原子加成在双键含氢原子较多的碳原子上。
15. 要制备高产率的CH
3CH
2CH
2NH
2,反应物CH
3CH
2CH
2Br和NH
3中,过量的应该是______。
NH3
[解析] NH3过量是生成丙胺的反应速率更大,由溴丙烷生成丙胺的平衡转化率更高。
16. 完成反应式(只写主产物):
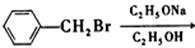
______。
[解析] 发生亲核取代反应,Wiliamson合成反应。
17. 化合物
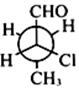
的系统命名是(标明绝对构型)______。
(2R)-2-氯丁醛
[解析] 注意区分R,S构型。让碳原子所连最小基团离眼睛最远,然后剩下三个基团从大到小排序,大小判定遵循次序规则。顺时针为R型,逆时针为S型。
18. 化合物
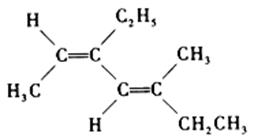
的系统命名是(用E/Z标记法标明构型)______。
(2Z,4E)-5-甲基-3-乙基-2,4-二庚烯
[解析] 两个双键较优基团分别位于双键同侧和异侧,属于Z、E构型,
19. 完成反应式(只写主产物):
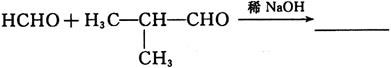
[解析] 反应物间发生的是羟醛缩合反应,与醛基直接相连的碳原子上的氢活性较大。
20. 由油酸、亚油酸和亚麻酸分别形成的三种油脂a、b、c中,碘值由大到小的顺序是______。
c>b>a
[解析] 碘值反映了油脂的不饱和度,碘值越大不饱和度越大。
21. 化合物
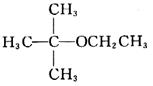
的名称是______;化合物

的名称是______。
乙基叔丁基醚;甘氨酰丙氨酸
[解析] 化合物1是醚类物质,化合物2是甘氨酸和丙氨酸形成二肽。
22. β-丁酮酸乙酯的结构式是______,三甲基苄基氯化铵的结构式是______。
23. 正己烷与水组成的二相体系中,______在上层,溴乙烷与水组成的二相体系中,______在上层。
正己烷;水
[解析] 正己烷不溶于水,相对密度小于水;溴乙烷不溶于水,相对密度大于水。
24. 完成反应式(只写主产物):

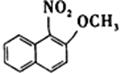
;
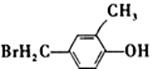
[解析] 萘环反应时,取代基主要进入α位;—CH2OH由于连在苯环双键的α位,活性较大。
25. 完成反应式:
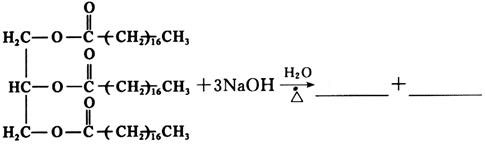
[解析] 酯在碱性条件下发生水解反应,生成羧酸和醇,羧酸进一步与碱反应。
三、计算、分析与合成题(共55分)1. 根据以下数据说明,为什么不能用CaCl
2和H
2CO
3水溶液混合得到CaCO
3沉淀?
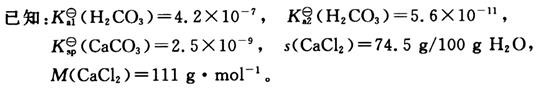
在碳酸水溶液中
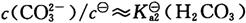
所以要生成碳酸钙沉淀,溶液中钙离子浓度最低为
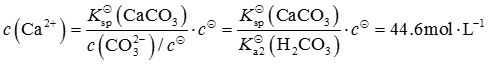
而即使在CaCl
2饱和溶液中,钙离子浓度约为
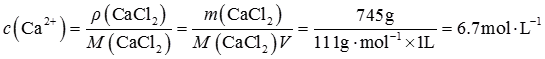
因此不能生成CaCO
3沉淀。
2. 已知H
3A的
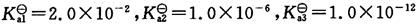
能否用0.1000mol·L
-1NaOH溶液直接准确滴定0.1mol·L
-1H
3A?如果直接准确滴定,有几个突跃?说明理由。
计算得(c/c

)K
a1>10
-8,但K
a1/K
a2<10
5,
故第一化学计量点附近无明显pH突跃。
(c/c

)K
a2>10
-8,且K
a2/K
a3>10
5,
故第二化学计量点附近有一明显pH突跃,可用指示剂检测,即滴定可准确进行。
滴定反应为H
3A+2OH
-=HA
2-+2H
2O,(c/c

)K
a3<10
-8 故第三化学计量点附近无明显pH突跃。
3. 将某含铁试液2.00mL定容至100.0mL,从中吸取2.00mL显色定容至50.00mL,用1cm比色皿测得透光度为39.8%,求原试液的铁的含量为多少g·L
-1?已知显色化合物的摩尔吸光系数为1.1×10
4L·mol
-1·cm
-1铁的相对分子质量为55.85。
根据吸光度与透光度的关系,可得A=-lgT=0.400
由朗伯-比尔定律,则
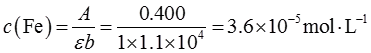
原试液铁的含量为:
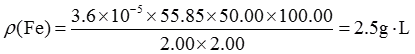
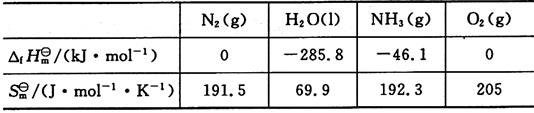
4. 根据以下热力学数据,判断在298K,标准状态下,如下反应能否进行?
N
2(g)+H
2O(l)→NH
3(g)+O
2(g)
2N
2(g)+6H
2O(l)=4NH
3(g)+3O
2(g)
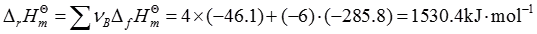
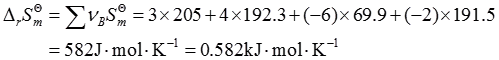
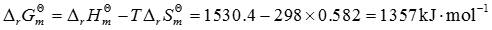
由于Δ
rG
m
>0,因此反应不能进行。
5. 标准浓度约为0.40mol·L
-1的KMnO
4标准溶液时,基准物Na
2C
2O
4的称量范围是多少?已知M(Na
2C
2O
4)=134.0g·mol
-1。
离子反应方程式
5H
2C
2O
4+2MnO
4-+6H
+=10CO
2+2Mn
2++8H
2O
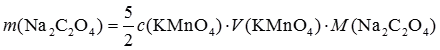
在滴定分析中,滴定体积一般控制在20到30mL之间。
当滴定体积为20mL时,m(Na
2C
2O
4)=0.27g
当滴定体积为30mL时,m(Na
2C
2O
4)=0.40g
因此,基准物称量范围为0.27~0.40g。
6. 用简便并能产生明显现象的化学方法,分别鉴定下列两组化合物(用流程图表示鉴别过程):
(1)苯酚,甲苯,氯苯
(2)苯胺,吡啶,噻吩
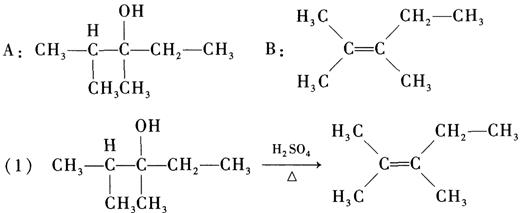
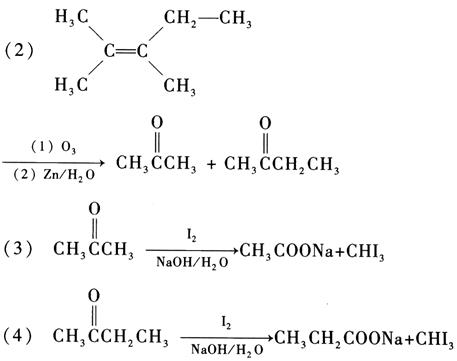
7. 化合物A(C
7H
16O)分子中的氧原子与手性碳原子相连,并且不能被K
2Cr
2O
7-H
2SO
4氧化成羰基化合物;A与浓硫酸共热生成化合物B(C
7H
14),B经臭氧氧化后在锌的保护下水解,得到的产物均不能还原Fehling溶液,但都可以发生碘仿反应,推测A和B的结构。写出所有相关反应方程式。
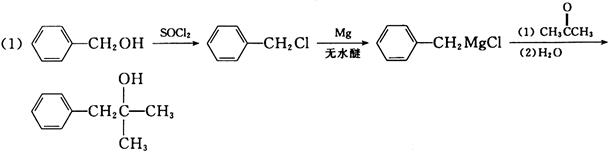
8. 按照要求制备下列物质(写出每一步的反应方程式和主要反应条件,无机试剂任选);
(1)由苯甲醇和三个碳及以下的有机试剂制备2-甲基-1-苯基-2-丙醇;
(2)由苯和三个碳及以下的有机试剂合成
 =1.12×10-12)在0.0010mol·L-1AgNO3溶液中的溶解度为s1,在0.0010mol·L-1K2CrO4溶液中的溶解度为s2,两者关系为______。
=1.12×10-12)在0.0010mol·L-1AgNO3溶液中的溶解度为s1,在0.0010mol·L-1K2CrO4溶液中的溶解度为s2,两者关系为______。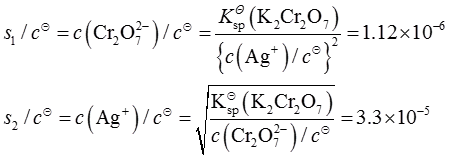
 ,温度相同时,反应速率越快,活化能越低。根据题意,在298K时,k正=100k逆,故正确答案为A。
,温度相同时,反应速率越快,活化能越低。根据题意,在298K时,k正=100k逆,故正确答案为A。 =6.4×10-15,25℃时Kw
=6.4×10-15,25℃时Kw =1.0×10-14,下列说法正确的是______。
=1.0×10-14,下列说法正确的是______。 增大,反应为吸热过程,自发的吸热反应必为熵增反应;B项,一定温度下,纯水的pH=pKw
增大,反应为吸热过程,自发的吸热反应必为熵增反应;B项,一定温度下,纯水的pH=pKw /2;C项,纯水中
/2;C项,纯水中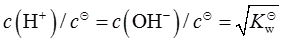
 ′MY≥5,lgαY(H)=lgK
′MY≥5,lgαY(H)=lgK MY-lgK
MY-lgK ’MY
’MY MY≥8,lgαY(H)=lgK
MY≥8,lgαY(H)=lgK ’MY-lgK
’MY-lgK MY
MY ′MY≥6,lgαY(H)=lgK
′MY≥6,lgαY(H)=lgK MY-lgK
MY-lgK ’MY
’MY MY≥6,lgαY(H)=lgK
MY≥6,lgαY(H)=lgK ’MY-lgK
’MY-lgK MY
MY ′MY≥6,lgαY(H)=lgK
′MY≥6,lgαY(H)=lgK MY-lgK
MY-lgK ’MY。
’MY。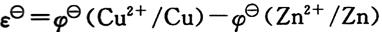
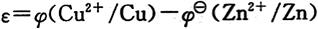
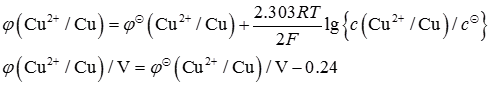
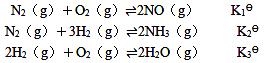
 为______。
为______。 )2·(K3
)2·(K3 )3·(K2
)3·(K2 )2
)2 )2·(K3
)2·(K3 )3/(K2
)3/(K2 )2
)2 )+3(K3
)+3(K3 )-2(K2
)-2(K2 )2
)2 )2/(K3
)2/(K3 )3·(K2
)3·(K2 )2
)2 (H2O2/H2O)=1.78V,φ
(H2O2/H2O)=1.78V,φ (Fe3+/Fe2+)=0.77V,φ
(Fe3+/Fe2+)=0.77V,φ (Cu2+/Cu)=0.34V,φ
(Cu2+/Cu)=0.34V,φ (Sn4+/Sn2+)=0.15V,下列各组物质在标准状态下能共存的是______。
(Sn4+/Sn2+)=0.15V,下列各组物质在标准状态下能共存的是______。 分别为-447.1kJ·mol-1和-429.5kJ·mol-1,白磷和红磷的ΔfHm
分别为-447.1kJ·mol-1和-429.5kJ·mol-1,白磷和红磷的ΔfHm (298K)分别为______。
(298K)分别为______。 {P(白磷)}=0
{P(白磷)}=0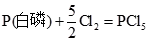 ;ΔrHm
;ΔrHm (1)=-447.1kJ·mol-1
(1)=-447.1kJ·mol-1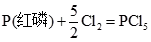 ;ΔrHm
;ΔrHm (2)=-429.5kJ·mol-1
(2)=-429.5kJ·mol-1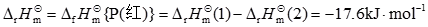
 的反应原料为______。
的反应原料为______。





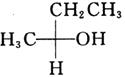
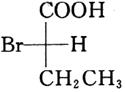
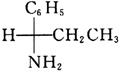
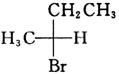

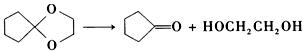 所使用的试剂和条件为______。
所使用的试剂和条件为______。 (O2/H2O)=1.23V,则在p(O2)=100kPa和pH=14.00的条件下,φ(O2/H2O)等于______V。
(O2/H2O)=1.23V,则在p(O2)=100kPa和pH=14.00的条件下,φ(O2/H2O)等于______V。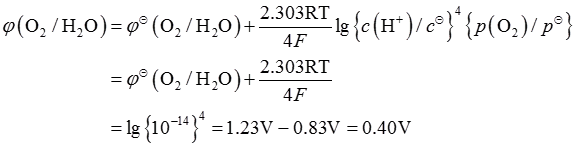
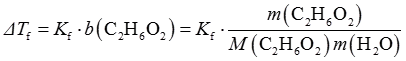
 最大的是______,最小的是______。
最大的是______,最小的是______。 (Ag+/Ag)
(Ag+/Ag) (AgBr/Ag)
(AgBr/Ag) (AgI/Ag)
(AgI/Ag) (AgCl/Ag)
(AgCl/Ag)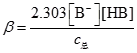 ,缓冲容量与总浓度有关。当C(HB):C(B-)=1:1时,缓冲容量最大,因此缓冲容量与共轭酸碱对的浓度比相关。
,缓冲容量与总浓度有关。当C(HB):C(B-)=1:1时,缓冲容量最大,因此缓冲容量与共轭酸碱对的浓度比相关。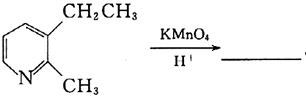
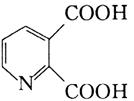
 可由
可由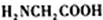 和______反应生成。
和______反应生成。
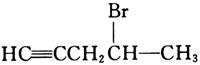
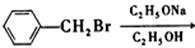 ______。
______。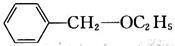
 的系统命名是(标明绝对构型)______。
的系统命名是(标明绝对构型)______。 的系统命名是(用E/Z标记法标明构型)______。
的系统命名是(用E/Z标记法标明构型)______。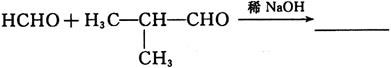
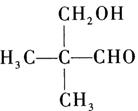
 的名称是______;化合物
的名称是______;化合物 的名称是______。
的名称是______。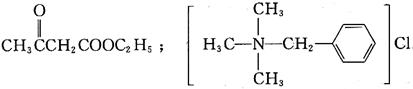

 ;
;
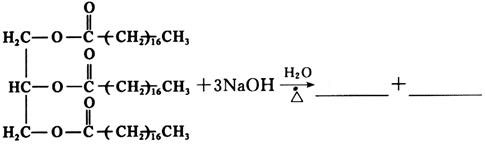

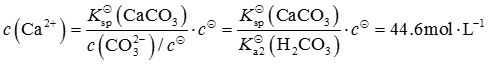
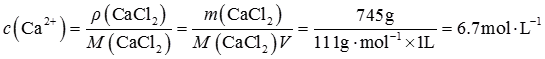
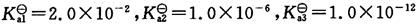
 )Ka1>10-8,但Ka1/Ka2<105,
)Ka1>10-8,但Ka1/Ka2<105, )Ka2>10-8,且Ka2/Ka3>105,
)Ka2>10-8,且Ka2/Ka3>105, )Ka3<10-8
)Ka3<10-8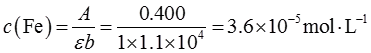
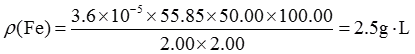

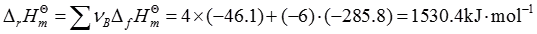
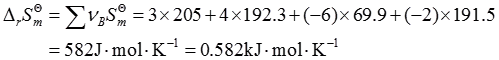
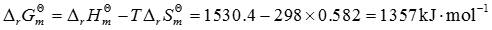
 >0,因此反应不能进行。
>0,因此反应不能进行。