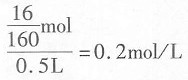二、填空题1. 目前,选入中学化学教材的化学基础理论,主要包括______、______、______、______等。
物质结构和元素周期律;溶液理论;化学反应速率和化学平衡;电化学基础
2. 中学化学教学中要着重培养学生的四种能力和一种精神,即______、观察能力、______、______和创新精神。
3. 教学方法是在教学过程中,为了完成______,使学生掌握______,由教学原则调节的师生协调活动的。
一、选择题3. 常温下,往H
2O
2溶液中滴加少量FeSO
4溶液,可发生如下两个反应:
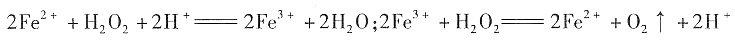
下列说法正确的是______
- A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
- B.在H2O2分解过程中,溶液的pH逐渐下降
- C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
- D.H2O2生产过程中混入Fe2+也不影响
A B C D
C
[解析] 结合两个方程式,根据氧化性、还原性强弱比较规律:得出H
2O
2的氧化性>Fe
3+的氧化性,H
2O
2的还原性>Fe
2+的还原性,A项错。H
2O
2的分解反应式可写为:
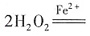
2H
2O+O
2↑,分解过程中,Fe
2+作催化剂,溶液pH值不变,B项错。H
2+O
2+分解时Fe
3+或Fe
2+作催化剂,所以分解过程中Fe
2+和Fe
3+的总量不变,C项正确。因为Fe
2+可导致H
2O
2分解,所以H
2O
2生产过程要避免混入Fe
2+,D项错。
5. 能在水溶液中大量共存的一组离子是______
A.H
+、I
-、
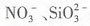
B.Ag
+、Fe
3+、Cl
-、
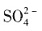
C.K
+、
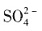
、CU
2+、
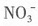
D.
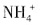
、OH
-、Cl
-、
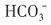
A B C D
C
[解析] 本题考查离子共存问题。
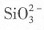
是硅酸的酸根与H
+不能大量共存,同时在酸陛溶液中,
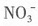
能氧化I
-生成单质碘,A项不正确;Ag
+与Cl
-和
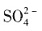
可生成难溶性物质AgCl和Ag
2SO
4,B项不正确;在碱性溶液中
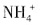
和
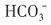
与OH
-结合分别形成氨水和
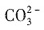
,因此D项也不正确,答案是C项。
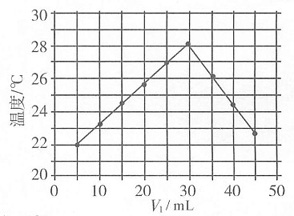
7. 室温下,将1.000mol·L
-1盐酸滴入20.00mL 1.000mol·L
-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关说法正确的是______
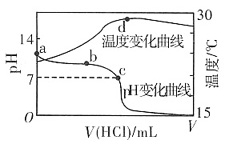
A.c点:c(Cl
-)=c
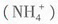
B.b点:c
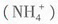
+c(NH
3·H
2O)=c(Cl
-)
C.a点由水电离出的c(H
+)=1.0×10
-14mol·L
-1 D.d点后,溶液温度略下降的主要原因是NH
3·H
2O电离吸热
A B C D
A
[解析] 由图像可知c点溶液显中性,由电荷守衡可知c(H
+)+c
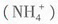
=c(OH
-)+c(Cl
-),所以c
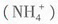
=c(Cl
-),A项正确。由图像可知剩余,即溶液是由氨水和氯化铵组成的,因此有c
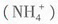
+c(NH
3·H
2O)>c(Cl
-),B项不正确。氨水属于弱碱,因此在1.000mol·L
-1氨水中OH
-的浓度不会是1.000mol·L
-1,而是小于1.000mol·L
-1,由水的离子积常数可知溶液中H
+的浓度应大于1.0×10
-14mol·L
-1,C项不正确。由图像可知d点后溶液中主要物质是NH
4Cl,而NH
4Cl水解要吸热,所以温度会略有降低,D项不正确。
11. 下列离子方程式正确的是______
A.铁与稀HNO
3反应:
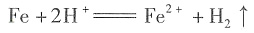
B.小苏打与氢氧化钠溶液混合:

C.氯化钙与碳酸氢钾溶液混合:
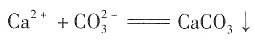
D.CuSO
4溶液与Ba(OH)
2溶液混合:
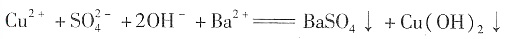
A B C D
D
[解析] 铁与稀HNO
3反应不产生H
2,而是产生NO气体,A项错;
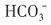
与OH
-生成
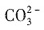
,而不是CO
2,B项错;碳酸氢钾写成离子形式为K
+、
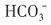
,而不可写成
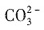
,C项错;D项,生成两种沉淀,正确。
12. 下列说法正确的是______
A.向0.1mol/L Na
2CO
3溶液中滴加酚酞,溶液变红
B.Al
3+、
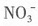
、Cl
-、
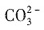
、Na
+可大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和H
2SO
4反应时,消耗NaOH的物质的量相同
A B C D
A
[解析] Na
2CO
3溶液水解显碱性,故加入酚酞是变红的,A项正确;pH=2为酸性溶液,含有大量H
+,可以与
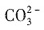
反应,不能共存,B项错;乙醇属于非电解质,C项错;H
2SO
4为二元酸,故等物质的量时,H
2SO
4消耗NaOH的物质的量是HCl的两倍,D项错。
14. 北京大学的两位教授率先发现人体心肺血管中存在微量硫化氢,它对调节心血管功能具有重要作用。下列叙述正确的是______
A.硫化氢分子很稳定,受热难分解
B.硫化氢分子中所有原子的最外电子层都达到8电子结构
C.将硫化氢通入溴水,溴水褪色
D.硫化氢是电解质,其电离方程式是
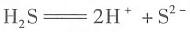
A B C D
C
[解析] 用排除法,硫化氢分子稳定性较差,受热易分解,反应式为
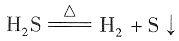
;H
2S分子中H原子只与S原子共用2个电子,H原子最外电子层只有2个电子,不是8个电子;H
2S是弱电解质,电离具有可逆性:
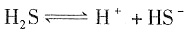
。
17. 得重感冒之后,常吃一种抗生素——头孢氨苄,分子式为C
16H
17N
3O
4S·H
2O,其化学结构式如右图所示。下列有关其说法正确的是______
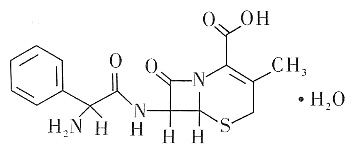
- A.该分子能与碳酸钠反应,不能与盐酸反应
- B.1mol该分子最多能与7mol H2反应
- C.在一定条件下,能发生水解反应生成氨基酸
- D.头孢氨苄易溶于水,能使溴水褪色
A B C D
C
[解析] 头孢氨苄中含有肽键、氨基、羧基、碳碳双键,故其水解能生成氨基酸;氨基的存在使得它有碱性,能与盐酸反应;由于肽键中的碳氧双键和羧基的碳氧双键难进行加成,故1mol头孢氨苄只能与4mol氢气反应;分子中亲水基不多,水溶性不大。
 同属于环烷烃
同属于环烷烃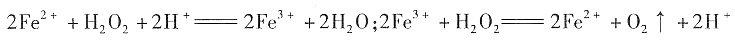
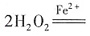 2H2O+O2↑,分解过程中,Fe2+作催化剂,溶液pH值不变,B项错。H2+O2+分解时Fe3+或Fe2+作催化剂,所以分解过程中Fe2+和Fe3+的总量不变,C项正确。因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D项错。
2H2O+O2↑,分解过程中,Fe2+作催化剂,溶液pH值不变,B项错。H2+O2+分解时Fe3+或Fe2+作催化剂,所以分解过程中Fe2+和Fe3+的总量不变,C项正确。因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D项错。 B.Ag+、Fe3+、Cl-、
B.Ag+、Fe3+、Cl-、
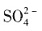 、CU2+、
、CU2+、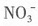 D.
D.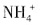 、OH-、Cl-、
、OH-、Cl-、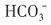
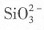 是硅酸的酸根与H+不能大量共存,同时在酸陛溶液中,
是硅酸的酸根与H+不能大量共存,同时在酸陛溶液中,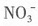 能氧化I-生成单质碘,A项不正确;Ag+与Cl-和
能氧化I-生成单质碘,A项不正确;Ag+与Cl-和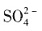 可生成难溶性物质AgCl和Ag2SO4,B项不正确;在碱性溶液中
可生成难溶性物质AgCl和Ag2SO4,B项不正确;在碱性溶液中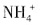 和
和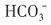 与OH-结合分别形成氨水和
与OH-结合分别形成氨水和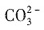 ,因此D项也不正确,答案是C项。
,因此D项也不正确,答案是C项。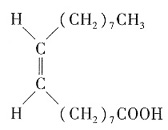

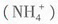
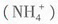 +c(NH3·H2O)=c(Cl-)
+c(NH3·H2O)=c(Cl-)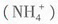 =c(OH-)+c(Cl-),所以c
=c(OH-)+c(Cl-),所以c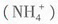 =c(Cl-),A项正确。由图像可知剩余,即溶液是由氨水和氯化铵组成的,因此有c
=c(Cl-),A项正确。由图像可知剩余,即溶液是由氨水和氯化铵组成的,因此有c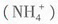 +c(NH3·H2O)>c(Cl-),B项不正确。氨水属于弱碱,因此在1.000mol·L-1氨水中OH-的浓度不会是1.000mol·L-1,而是小于1.000mol·L-1,由水的离子积常数可知溶液中H+的浓度应大于1.0×10-14mol·L-1,C项不正确。由图像可知d点后溶液中主要物质是NH4Cl,而NH4Cl水解要吸热,所以温度会略有降低,D项不正确。
+c(NH3·H2O)>c(Cl-),B项不正确。氨水属于弱碱,因此在1.000mol·L-1氨水中OH-的浓度不会是1.000mol·L-1,而是小于1.000mol·L-1,由水的离子积常数可知溶液中H+的浓度应大于1.0×10-14mol·L-1,C项不正确。由图像可知d点后溶液中主要物质是NH4Cl,而NH4Cl水解要吸热,所以温度会略有降低,D项不正确。 +O2↑,根据缺什么补什么的原则可推出选项C正确。
+O2↑,根据缺什么补什么的原则可推出选项C正确。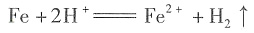

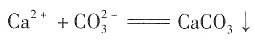
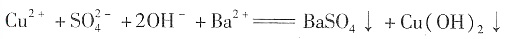
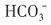 与OH-生成
与OH-生成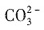 ,而不是CO2,B项错;碳酸氢钾写成离子形式为K+、
,而不是CO2,B项错;碳酸氢钾写成离子形式为K+、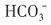 ,而不可写成
,而不可写成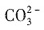 ,C项错;D项,生成两种沉淀,正确。
,C项错;D项,生成两种沉淀,正确。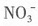 、Cl-、
、Cl-、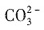 、Na+可大量共存于pH=2的溶液中
、Na+可大量共存于pH=2的溶液中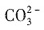 反应,不能共存,B项错;乙醇属于非电解质,C项错;H2SO4为二元酸,故等物质的量时,H2SO4消耗NaOH的物质的量是HCl的两倍,D项错。
反应,不能共存,B项错;乙醇属于非电解质,C项错;H2SO4为二元酸,故等物质的量时,H2SO4消耗NaOH的物质的量是HCl的两倍,D项错。
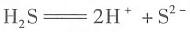
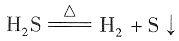 ;H2S分子中H原子只与S原子共用2个电子,H原子最外电子层只有2个电子,不是8个电子;H2S是弱电解质,电离具有可逆性:
;H2S分子中H原子只与S原子共用2个电子,H原子最外电子层只有2个电子,不是8个电子;H2S是弱电解质,电离具有可逆性: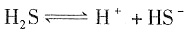 。
。

 ,根据反应后气体体积为反应前气体体积的一半,可以得到x=1,只有A选项符合题意。
,根据反应后气体体积为反应前气体体积的一半,可以得到x=1,只有A选项符合题意。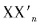 (n=1,3,5,7;且非金属性X'>X)。卤素互化物大多为强氧化剂。回答下列问题:
(n=1,3,5,7;且非金属性X'>X)。卤素互化物大多为强氧化剂。回答下列问题: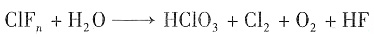 ,若ClFn与H2O的物质的量之比为3:5,求n的值。
,若ClFn与H2O的物质的量之比为3:5,求n的值。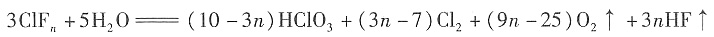
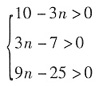
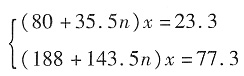
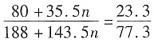 ,解得n≈3
,解得n≈3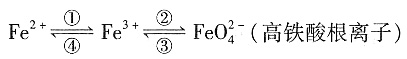
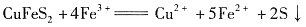 。CuFeS2中S为-2价,则下列说法正确的是______(选填序号)。
。CuFeS2中S为-2价,则下列说法正确的是______(选填序号)。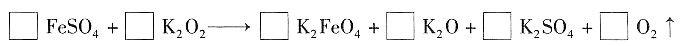

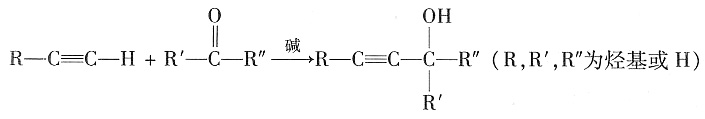
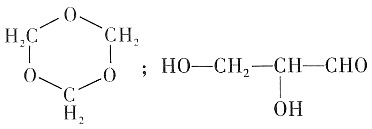
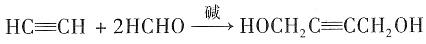 ;加成反应
;加成反应
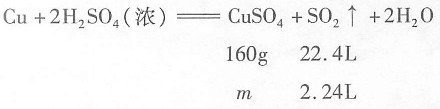
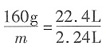 ,解之得m=16g
,解之得m=16g