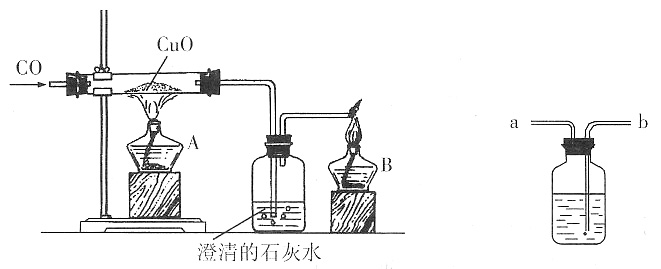
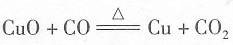
二、填空题1. 我国的基础教育化学新课程是从______、______、______等三个方面,来阐述科学素养的含义。
2. 从理论上说,以实验为基础中的“实验”有四重含义,即______、______、______、______、和______。
3. 化学课程标准明确提出了与新课程相适应的三种评价方式,即______、______、______。
三、论述题1. 简述有机化合物知识的教学要求。
(1)要以碳原子结构的特点为中心,以官能团为主线组织教学;
(2)结合有机物的特点,加强化学用语的教学;
(3)要重视模型在有机化合物教学中的应用;
(4)要密切联系生产、生活实际,提高学习兴趣;
(5)要使概念明晰、知识系统化。
2. 为了搞好素质教育,搞好化学教学,你认为必须树立哪些新理念?
(1)化学教学要面向全体学生,以人为本,注重学生的全面发展;
(2)化学教学要提高学生的科学素养与人文精神;
(3)以科学探究为突破口,促进学生学习方式的转变;
(4)化学教学要注意贴近学生的生活,联系社会实际;
(5)提供多样化的学习评价方式,促进学生发展;
(6)努力培养学生终身学习的愿望和能力,让学生乐于学习、学会学习,增长发展潜能。
一、选择题4. 对滴有酚酞试液的下列溶液,操作后颜色变深的是______
- A.明矾溶液加热
- B.CH3COONa溶液加热
- C.氨水中加入少量NH4Cl固体
- D.小苏打溶液中加入少量NaCl固体
A B C D
B
[解析] 本题考查外界条件对盐类水解及电离平衡的影响。盐类水解是吸热的,因此加热有利于水解反应向正方应方向移动,明矾中的Al
3+水解,方程式为
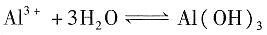
+3H
+,加热时酸性会增强,颜色变浅,A项不正确。CH
3COONa水解显碱性,水解反应式为

,加热时碱性会增强,所以溶液颜色会变深,B项正确。氨水显碱性,溶液中存在下列电离平衡

,加入少量NH
4Cl固体,会增大
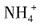
的浓度,抑制氨水的电离,从而降低碱性,颜色会变浅,C项不正确。NaHCO
3属于强电解质,电离方程式为
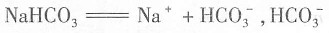
同时存在电离和水解平衡,方程式分别为
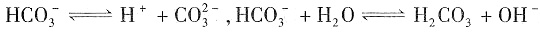
;由于水解程度大于电离程度,所以NaHCO
3溶液显弱碱性,但加入少量NaCl固体时,对两个平衡不会产生影响,即颜色不发生变化,D项不正确。
5. 为检验某卤代烃(R—X)中的X元素,有下列实验操作:①加热煮沸;②加入AgNO
3溶液;③取少量卤代烃;④加入稀硝酸酸化;⑤加入NaOH溶液;⑥冷却。正确操作的先后顺序是______
- A.③①⑤⑥②④
- B.③②①⑥④⑤
- C.③⑤①⑥④②
- D.③⑤①⑥②④
A B C D
C
[解析] 卤代烃(R—X)中只有卤原子,并无卤离子,而Ag
+只与X
-产生AgX↓,故必须使卤代烃中的—X转化为X
-,再根据AgX沉淀颜色与质量来确定卤代烃中卤原子的种类和数目。故第一步可通过水解或消去反应,但此时溶液中有碱存在,得到的沉淀往往是褐色的,发生的反应为
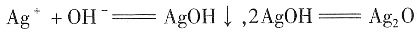
(褐色,微溶于水)+H
2O。因此必须在水解或消去后往溶液中加入HNO
3调节至酸性,再加入AgNO
3。
9. 欲使x溶液滴到y溶液中能产生如下图所示的氢氧化铝沉淀曲线,则下列能符合该条件的是______
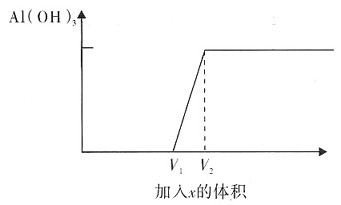
- A.x为NaOH,y为AlCl3
- B.x为AlCl3,y为NaOH
- C.x为NaAlO2,y为HCl
- D.x为HCl,y为NaAlO2
A B C D
B
[解析] 显然,选项A、D从x开始加进去,就产生沉淀是不符合题意的。选项B、C从x加进去一定体积后才产生沉淀,再加进去一定体积,沉淀量达到最大,而后沉淀量不再随x的多少而改变,现在就要研究两段体积的大小关系。
对于选项B,把AlCl,加到NaOH溶液后发生下列反应:
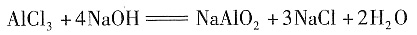
从方程式可以看出加入AlCl
3的物质的量应为原NaOH溶液物质的量的
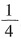
,继续滴加AlCl
3,发生双水解反应:
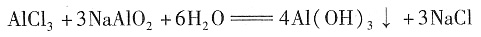
再加入AlCl
3的物质的量为NaAlO
2的
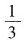
,即为原.NaOH溶液物质量的
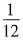
,与图像相符合。
对于选项C,把NaAlO
2加到HCl溶液中,由于HCl过量,只生成AlCl
3,而无沉淀。
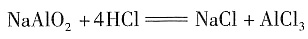
加入NaAlO
2的物质的量应为原HCl的物质的量的
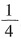
。
继续滴加NaAlO
2发生双水解反应,反应方程式同上。发现再加入的NaAlO
2的物质的量为AlCl
3的3倍,为原HCl的
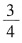
,与图像不符。
12. 研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。下列关于该电池的说法不正确的是______
A.水既是氧化剂又是溶剂 B.放电时正极上有氢气生成
C.放电时OH
-向正极移动 D.总反应为:

A B C D
C
[解析] 考生可能迅速选出C项是错误,因为原电池放电时OH
-是向负极移动的。这种电池名称叫锂水电池,可推测其总反应为:

。其电极反应如下所示:
(-)
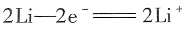
(+)

结合分析可知选项A、B、D都是正确的。
14. X、Y、Z、R是1~18号元素中的四种元素,它们的原子结构有以下特点:
①元素X原子的M层比L层少3个电子;
②元素Y的2价阴离子的核外电子排布与氖原子相同;
③元素Z原子的L层比M层多5个电子;
④元素R原子的L层比K层多3个电子。
其中金属性最强的是______
A B C D
C
[解析] 根据4种原子的电子层结构特点可推断出X为P元素,Y为O元素,Z为Al元素,R为N元素,所以其中金属性最强的是Al,即Z。
15. 有①、②、③三瓶体积相等,浓度都是1mol·L
-1的盐酸溶液,将①加热蒸发至原体积的一半;向②中加入少量的CH
3COONa同体(加入后仍显酸性);③不作任何改变,以酚酞作指示剂。用NaOH溶液滴定上述三种溶液,所耗NaOH溶液的体积为______
- A.③=②>①
- B.③>②>①
- C.①=②>③
- D.①=②=③
A B C D
A
[解析] 本题着重考查酸碱中和、溶液的酸碱性判断及抽象思维能力。将①加热蒸发,由于HCl的挥发性比水大,故蒸发后溶液中可以认为是没有HCl的,消耗NaOH溶液的体积最少;在②中加入CH
3COONa固体,发生反应:

;当以酚酞作指示剂时,HCl、CH
3COOH被NaOH中和:
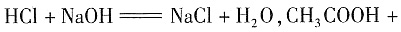
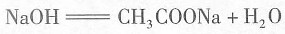
,此过程中被中和的H
+物质的量与③相同。
18. 锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1mol硝酸锌时,被还原的硝酸的物质的量为______
- A.2mol
- B.1mol
- C.0.5mol
- D.0.25mol
A B C D
D
[解析] 此题主要考查氧化还原反应方程式的配平:
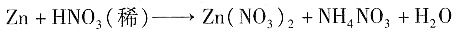
Zn:0→+2,化合价改变值为:(2-0)×1=2
N:+5→-3,化合价的改变值为:(5+3)×1=8
根据化合价升降总值相等得:在Zn(NO
3)
2前配4,NH
4NO
3前配1,然后根据反应前后各元素的原子个数相等,找出其他物质的系数。配平后的化学方程式为:
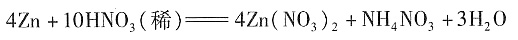
当生成1mol的Zn(NO
3)
2时,被还原的HNO
3为0.25mol。
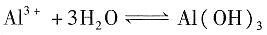 +3H+,加热时酸性会增强,颜色变浅,A项不正确。CH3COONa水解显碱性,水解反应式为
+3H+,加热时酸性会增强,颜色变浅,A项不正确。CH3COONa水解显碱性,水解反应式为 ,加热时碱性会增强,所以溶液颜色会变深,B项正确。氨水显碱性,溶液中存在下列电离平衡
,加热时碱性会增强,所以溶液颜色会变深,B项正确。氨水显碱性,溶液中存在下列电离平衡 ,加入少量NH4Cl固体,会增大
,加入少量NH4Cl固体,会增大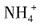 的浓度,抑制氨水的电离,从而降低碱性,颜色会变浅,C项不正确。NaHCO3属于强电解质,电离方程式为
的浓度,抑制氨水的电离,从而降低碱性,颜色会变浅,C项不正确。NaHCO3属于强电解质,电离方程式为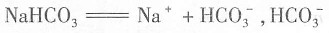 同时存在电离和水解平衡,方程式分别为
同时存在电离和水解平衡,方程式分别为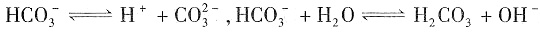 ;由于水解程度大于电离程度,所以NaHCO3溶液显弱碱性,但加入少量NaCl固体时,对两个平衡不会产生影响,即颜色不发生变化,D项不正确。
;由于水解程度大于电离程度,所以NaHCO3溶液显弱碱性,但加入少量NaCl固体时,对两个平衡不会产生影响,即颜色不发生变化,D项不正确。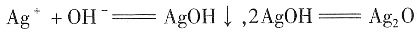 (褐色,微溶于水)+H2O。因此必须在水解或消去后往溶液中加入HNO3调节至酸性,再加入AgNO3。
(褐色,微溶于水)+H2O。因此必须在水解或消去后往溶液中加入HNO3调节至酸性,再加入AgNO3。
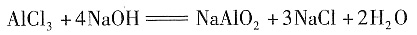
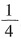 ,继续滴加AlCl3,发生双水解反应:
,继续滴加AlCl3,发生双水解反应: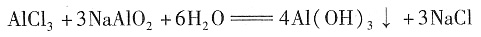
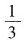 ,即为原.NaOH溶液物质量的
,即为原.NaOH溶液物质量的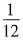 ,与图像相符合。
,与图像相符合。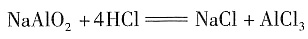
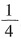 。
。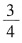 ,与图像不符。
,与图像不符。

 。其电极反应如下所示:
。其电极反应如下所示:

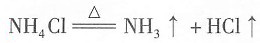
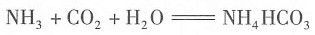
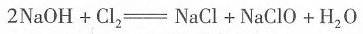

 ;当以酚酞作指示剂时,HCl、CH3COOH被NaOH中和:
;当以酚酞作指示剂时,HCl、CH3COOH被NaOH中和: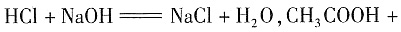
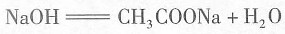 ,此过程中被中和的H+物质的量与③相同。
,此过程中被中和的H+物质的量与③相同。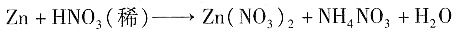
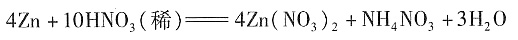
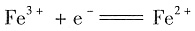 电极反应中,加入Fe3+的络合剂F-,则使电极电势的数值______;在
电极反应中,加入Fe3+的络合剂F-,则使电极电势的数值______;在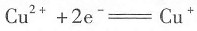 电极反应中,加入Cu+的沉淀剂I-可使其电极电势的数值______。
电极反应中,加入Cu+的沉淀剂I-可使其电极电势的数值______。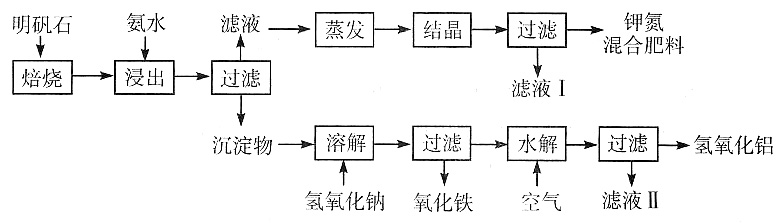
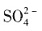 外,还有大量的
外,还有大量的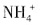 。检验
。检验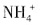 的方法是______。
的方法是______。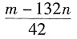
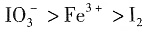 ;还原性:
;还原性: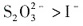
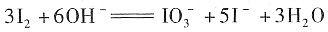
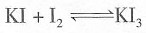
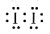
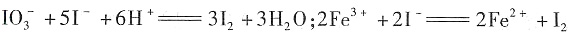
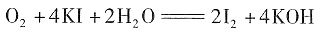 ;否;KI3在受热(或潮湿)条件下产生I2和KI,KI易被氧气氧化,I2易升华
;否;KI3在受热(或潮湿)条件下产生I2和KI,KI易被氧气氧化,I2易升华