银符考试题库B12
现在是:
试卷总分:100.0
您的得分:
考试时间为:
点击“开始答卷”进行答题
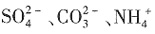 、Fe3+、Al3+和K+,取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中______。
、Fe3+、Al3+和K+,取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中______。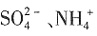 一定存在,Cl-可能不存在
一定存在,Cl-可能不存在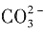 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在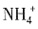 ,而且为0.02mol,同时产生红褐色沉淀,说明有Fe3+,而且为0.02mol,由于Fe3+和
,而且为0.02mol,同时产生红褐色沉淀,说明有Fe3+,而且为0.02mol,由于Fe3+和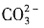 会发生双水解,一定没有
会发生双水解,一定没有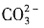 ,根据加入BaCl2溶液,得到不溶于盐酸的4.66g沉淀,说明有
,根据加入BaCl2溶液,得到不溶于盐酸的4.66g沉淀,说明有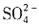 ,且为0.02mol,则根据电荷守恒可知一定有Cl-,至少有0.04mol,物质的量浓度至少为0.4mol/L。由以上分析可知,溶液中至少存在
,且为0.02mol,则根据电荷守恒可知一定有Cl-,至少有0.04mol,物质的量浓度至少为0.4mol/L。由以上分析可知,溶液中至少存在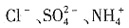 、Fe3+4种离子,无法判断Al3+和K+是否存在,一定存在Cl-。故本题选A。
、Fe3+4种离子,无法判断Al3+和K+是否存在,一定存在Cl-。故本题选A。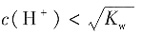
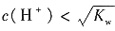 ;C项,该溶液中一定存在水的电离平衡;D项,由于水的电离为吸热反应,温度升高电离程度增大,溶液中H+浓度增大,溶液pH减小,此时溶液的pH小于7。故本题选C
;C项,该溶液中一定存在水的电离平衡;D项,由于水的电离为吸热反应,温度升高电离程度增大,溶液中H+浓度增大,溶液pH减小,此时溶液的pH小于7。故本题选C 也完全反应,生成一种氮氧化物NyOx,则该氮氧化物的化学式是______。
也完全反应,生成一种氮氧化物NyOx,则该氮氧化物的化学式是______。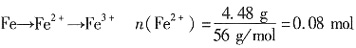 ,则电子转移0.08mol,设N由+5→+x价,0.08=(5-x)×0.02,则x=1,N变为+1价,故选A。
,则电子转移0.08mol,设N由+5→+x价,0.08=(5-x)×0.02,则x=1,N变为+1价,故选A。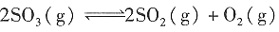 ΔH=+QkJ/mol
ΔH=+QkJ/mol 完全沉淀:
完全沉淀: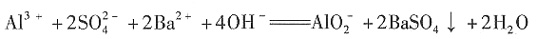
 完全沉淀:
完全沉淀: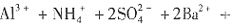 4OH-====Al(OH)3↓+NH3·H2O+2BaSO4↓。
4OH-====Al(OH)3↓+NH3·H2O+2BaSO4↓。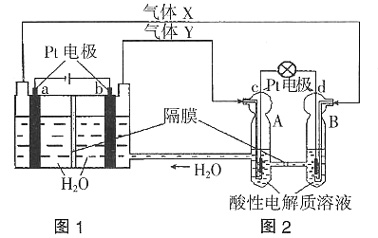
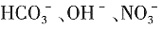 等八种离子中的某几种,该溶液能跟金属铝反应,且放出的气体只有氢气。
等八种离子中的某几种,该溶液能跟金属铝反应,且放出的气体只有氢气。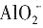 ,则原溶液里一定大量含有的物质是______(写化学式),发生反应的离子方程式为______。还可能大量存在的物质是______。
,则原溶液里一定大量含有的物质是______(写化学式),发生反应的离子方程式为______。还可能大量存在的物质是______。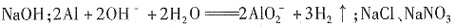
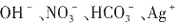
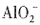 ,说明原溶液中一定含有OH-,而
,说明原溶液中一定含有OH-,而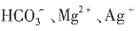 H+均不能在碱溶液中存在。由溶液的电中性可知,溶液中肯定有阳离子Na+,但Cl-、
H+均不能在碱溶液中存在。由溶液的电中性可知,溶液中肯定有阳离子Na+,但Cl-、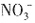 不能确定。因此,原溶液中一定大量含有的物质是NaOH,可能含有的大量物质是NaCl、NaNO3。
不能确定。因此,原溶液中一定大量含有的物质是NaOH,可能含有的大量物质是NaCl、NaNO3。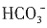 、OH-与H+不能共存。酸性条件下,当有
、OH-与H+不能共存。酸性条件下,当有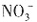 存在时,溶液与铝作用不放出H2,故溶液不含
存在时,溶液与铝作用不放出H2,故溶液不含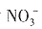 。由溶液的电中性可知,溶液中的阴离子只能是Cl-,而Cl-与Ag+不能共存,故溶液中不存在Ag+。因此,原溶液中一定不能大量存在的离子是
。由溶液的电中性可知,溶液中的阴离子只能是Cl-,而Cl-与Ag+不能共存,故溶液中不存在Ag+。因此,原溶液中一定不能大量存在的离子是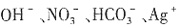 。
。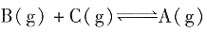
 。
。
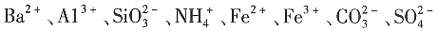 、
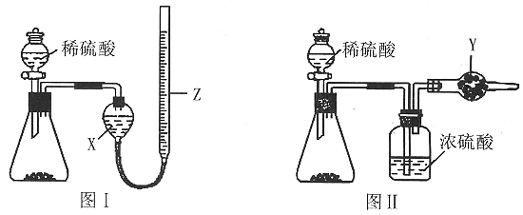
、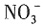 中的一种或几种,取该溶液进行连续实验,实验过程如下:
中的一种或几种,取该溶液进行连续实验,实验过程如下: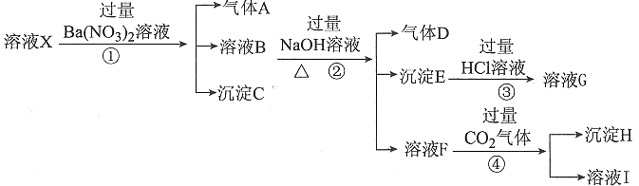

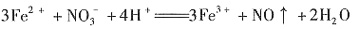
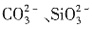 与H+不能共存,溶液中一定不存在
与H+不能共存,溶液中一定不存在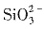 和
和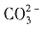 。加入过量Ba(NO3)2,生成沉淀C为BaSO4,则溶液X中存在
。加入过量Ba(NO3)2,生成沉淀C为BaSO4,则溶液X中存在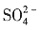 ,一定不存在Ba2+。溶液X与过量Ba(NO3)2溶液生成气体A,则X中存在Fe2+或Fe2+、Fe3+,一定不存在
,一定不存在Ba2+。溶液X与过量Ba(NO3)2溶液生成气体A,则X中存在Fe2+或Fe2+、Fe3+,一定不存在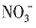 ,A为NO。溶液B与过量NaOH溶液加热生成气体D,可知B中一定存在
,A为NO。溶液B与过量NaOH溶液加热生成气体D,可知B中一定存在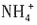 ,D为NH3。溶液B与过量NaOH溶液生成溶液F,则B中一定有Al3+。
,D为NH3。溶液B与过量NaOH溶液生成溶液F,则B中一定有Al3+。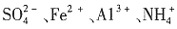 ,可能存在Fe3+。
,可能存在Fe3+。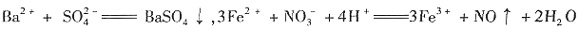 ;②中发生反应:
;②中发生反应: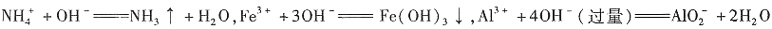 ,③中发生反应:Fe(OH)3+3H+====Fe3++3H2O,④中发生反应:
,③中发生反应:Fe(OH)3+3H+====Fe3++3H2O,④中发生反应: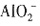 +2H2O+CO2(过量)====Al(OH)3↓+
+2H2O+CO2(过量)====Al(OH)3↓+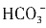 。属于氧化反应的是①。
。属于氧化反应的是①。 。
。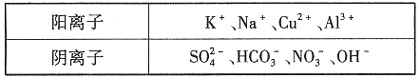
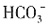 ,故A为NaHCO3,C、D中含有
,故A为NaHCO3,C、D中含有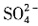 ,故D为CuSO4,C为KAl(SO4)2,最后可判定B为KNO3。
,故D为CuSO4,C为KAl(SO4)2,最后可判定B为KNO3。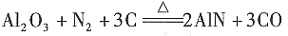

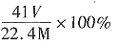
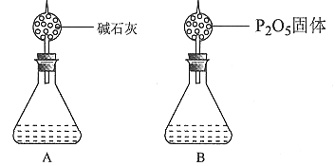
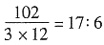 。
。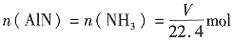 ,AlN样品的纯度为
,AlN样品的纯度为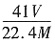 ×100%。
×100%。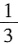 左右,导电性仅次于银、钢和金。
左右,导电性仅次于银、钢和金。| 教学环节 | 教学内容 | 教师活动 | 学生活动 |
| 导入 | 1.铝作为一种金属具有的性质 2.铝作为一种金属材料相关的性质 |
设置问题,引导思考 | 根据初中学过的金属的知识和 生活经验讨论作答 |
| 观察思考 | 实验1:铝与氧气反应 实验2:铝与三氧化二铁反应 |
演示实验,引导学生观察 和思考 |
观察并讨论实验现象,得出相 关的化学反应,写出化学反应 方程式 |
| 实验探究 | 实验1:铝与酸反应 实验2:铝与碱反应 |
引导学生实验,与生活实 际联系,启发学生学习铝 的两性 |
学生实验,观察实验现象,回顾 金属的还原性性质,学习铝的 两性,写出化学反应方程式 |
| 小结 | 本节课主要的化学反应及其在生 产生活中的意义 |
启发引导,归纳总结 | 积极思考,参与归纳 |
| 作业 | 观察生活中的铝制品,查阅铝的使 用历史 |
||
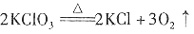
 左右,常温下易被空气中的氧气氧化形成致密的氧化物薄膜,阻止内部的金属继续与氧气反应,可制成轻便的日常用品;导电性仅次于银、钢和金,用作导线;氧化铝为原子晶体,熔点高,可作耐火材料;铝与金属氧化物反应表现出较强的还原性,用于工业生产。
左右,常温下易被空气中的氧气氧化形成致密的氧化物薄膜,阻止内部的金属继续与氧气反应,可制成轻便的日常用品;导电性仅次于银、钢和金,用作导线;氧化铝为原子晶体,熔点高,可作耐火材料;铝与金属氧化物反应表现出较强的还原性,用于工业生产。| 实验内容 | 实验现象 | 结论 |
| 实验1 | 放出大量的热,发出耀眼白光,生成白色固体 | 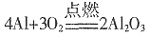 |
| 实验2 | 生成黑色熔融状的金属 | 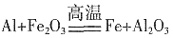 |
