银符考试题库B12
现在是:
试卷总分:100.0
您的得分:
考试时间为:
点击“开始答卷”进行答题

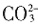 数目为2NA
数目为2NA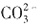 会发生水解,生成
会发生水解,生成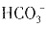 ,所以n(
,所以n(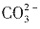 )<n(Na2CO3)=2mol,A项错误;标准状况下,2.24LCl2为0.1mol,与足量Mg反应生成MgCl2,转移2×0.1mol电子,即0.2NA电子,B项正确;CnH2n的相对分子质量为14n,H原子数目为
)<n(Na2CO3)=2mol,A项错误;标准状况下,2.24LCl2为0.1mol,与足量Mg反应生成MgCl2,转移2×0.1mol电子,即0.2NA电子,B项正确;CnH2n的相对分子质量为14n,H原子数目为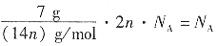 ,C项错误;标准状况下的CH2Cl2是液态的,无法仅根据其体积确定其物质的量,D项错误。
,C项错误;标准状况下的CH2Cl2是液态的,无法仅根据其体积确定其物质的量,D项错误。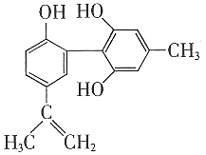
 ,达到平衡时体积变为1.3L。这时NO2的转化率为______。
,达到平衡时体积变为1.3L。这时NO2的转化率为______。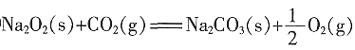 ;ΔH2=-266kJ·mol-1。
;ΔH2=-266kJ·mol-1。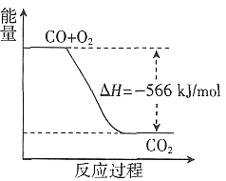
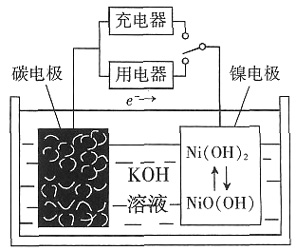
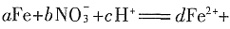 fFe3++gNO↑+hNO2↑+kH2O。下列有关推断中,不正确的是______。
fFe3++gNO↑+hNO2↑+kH2O。下列有关推断中,不正确的是______。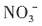 将铁氧化成Fe3+可知,HNO3的氧化性大于Fe3+,C项正确。当a不变时,d+f的和不变,当b增大时,不能确定d一定增大。D项错误。
将铁氧化成Fe3+可知,HNO3的氧化性大于Fe3+,C项正确。当a不变时,d+f的和不变,当b增大时,不能确定d一定增大。D项错误。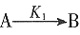 的活化能大于反应②
的活化能大于反应②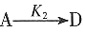 ,以下不能改变B、D生成比例的是______。
,以下不能改变B、D生成比例的是______。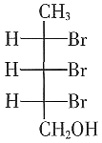
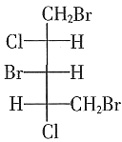
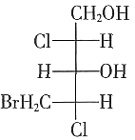
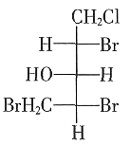
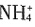 B.N2 C.CCl4 D.CO2
B.N2 C.CCl4 D.CO2 ,在一定温度下达到平衡,H2的转化率为25%。若在同一容器中充入NH3,欲达到平衡时的各成分的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量和达到平衡时NH3的转化率是______。
,在一定温度下达到平衡,H2的转化率为25%。若在同一容器中充入NH3,欲达到平衡时的各成分的百分含量与上述平衡时相同,则起始时充入的NH3的物质的量和达到平衡时NH3的转化率是______。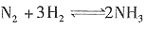 ,因为H2的转化率为25%,故H2的反应量为30×25%=7.5mol。故N2的反应量为
,因为H2的转化率为25%,故H2的反应量为30×25%=7.5mol。故N2的反应量为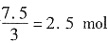 。故剩余的N2和H2的物质的量分别为10-2.5=7.5mol和30-7.5=22.5mol。生成的NH3为5mol。所以设起始充入的NH3的物质的量为n,达到平衡时NH3的转化率为x,则平衡时N2、H2和NH3的物质的量分别为
。故剩余的N2和H2的物质的量分别为10-2.5=7.5mol和30-7.5=22.5mol。生成的NH3为5mol。所以设起始充入的NH3的物质的量为n,达到平衡时NH3的转化率为x,则平衡时N2、H2和NH3的物质的量分别为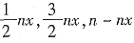 ,则
,则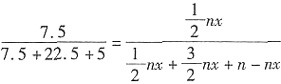 ,解得:x=75%。
,解得:x=75%。 ;ΔH>0,当反应达到平衡时,下列措施:
;ΔH>0,当反应达到平衡时,下列措施: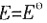 D.E=0
D.E=0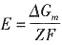 ,所以E=0。
,所以E=0。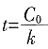 ,该反应的反应级数为______。
,该反应的反应级数为______。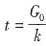 ,所以υ=
,所以υ=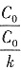 =k。故该反应的反应级数为零级。
=k。故该反应的反应级数为零级。 中;ΔH>0,m+n>p+q。A的质量分数与温度、压强关系正确的是______。
中;ΔH>0,m+n>p+q。A的质量分数与温度、压强关系正确的是______。
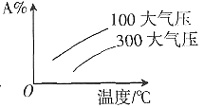
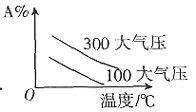
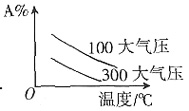
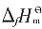 为______。
为______。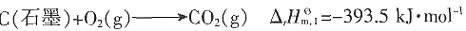
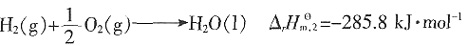
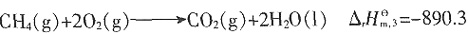 kJ·mol-1
kJ·mol-1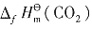 =-393.5kJ·mol-1,
=-393.5kJ·mol-1,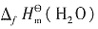 =-285.8kJ·mol-1。所以
=-285.8kJ·mol-1。所以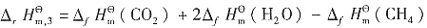 ,即
,即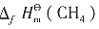 =-393.5-2×285.8+890.3=-74.8 kJ·mol-1。
=-393.5-2×285.8+890.3=-74.8 kJ·mol-1。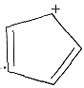
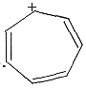
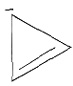
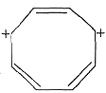
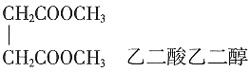
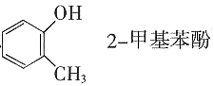
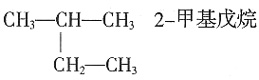
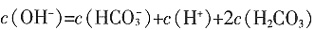
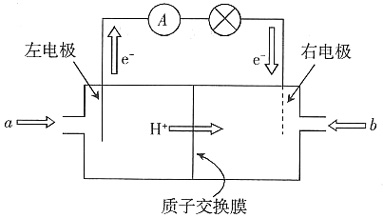
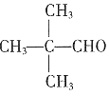
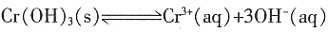 ,Ksp=10-32(常温),要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______。
,Ksp=10-32(常温),要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______。
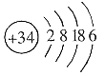
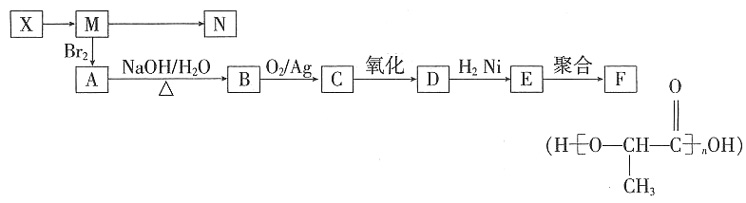

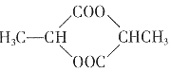
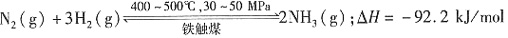

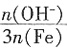 ×100%。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。试回答下列问题。
×100%。式中n(OH-)、n(Fe)分别表示固体聚合硫酸铁中OH-和Fe元素的物质的量。试回答下列问题。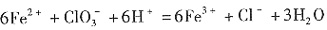
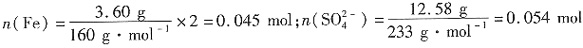 ;n(OH-)=3×n(Fe)-2×n
;n(OH-)=3×n(Fe)-2×n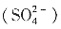 =0.027mol,盐基度
=0.027mol,盐基度 。
。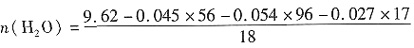 =0.08mol,故聚合硫酸铁样品化学式为Fe45(OH)27(SO4)54·81H2O
=0.08mol,故聚合硫酸铁样品化学式为Fe45(OH)27(SO4)54·81H2O| 教师活动 | 学生活动 | |
| 课堂 引入 | [引入]人们常用离子的特征反应来检验一些常见离子,例 如:可以利用Fe3+与SCN-反应生成血红色溶液这一性质来 检验Fe3+。像这样只检验种类,不测定含量的分析方法,化 学上称为定性分析。 有时,我们还需要测定某些物质或元素的含量,这就需要用 到另一种分析方法——定量分析。今天,我们来学习一种 重要的定量分析方法——酸碱中和滴定。 | |
| 概念及 原理 介绍 | [板书]酸碱中和滴定 1.定义:用已知物质的量浓度的酸(或碱)来测定未知物质 的量浓度的碱(或酸)的方法。 2.原理:酸碱中和反应实质 (a) (用离子方程式表示) 则:n(H+)=n(OH-) 即:c(H+)×V(H+)=c(OH-)×V(OH-) | 听讲、记好笔记 |
| 认识滴 定管和 指示剂 | [过渡]酸碱中和滴定在理论上是简单清晰的。但在具体的 实践操作中,还有两个关键需要克服。A.准确测定参加反应 的两种溶液的体积:B.准确判断中和反应恰好进行完全(找 到完全中和点)。下面就一起学习如何解决理论到实践中 出现的问题。 [讲评]解决办法 A.准确测定参加反应的两种溶液的体积:使用滴定管(展示 滴定管,放在滴定管夹上) [互动1]请大家观察自己桌上的滴定管,并试着说明它的结 构特点。 [讲解] 酸式滴定管:盛放酸性溶液,不能盛放碱性溶液。 (因为 (b) ) 碱式滴定管:盛放碱性溶液,不能盛放酸性溶液和强氧化性 溶液。(因为橡皮管容易被腐蚀,结构决定适用范围) [互动2]为什么酸碱中和滴定中测定溶液的体积不用已有 的量筒,而选用滴定管? (评讲中可与量筒对比说明,并演示滴定管用于精确的测量 放出的液体的体积。) B.准确判断中和反应恰好进行完全——选用合适指示剂。 (指导阅读材料) | [互动1]学生观察讨论,举手发言,并最 后总结: 1)内径均匀、带有刻度的细长玻璃管: 0刻度在上、从上往下分布刻度、最大量 程下端有一段无刻度。 2)滴定管上标有参数——温度、最大量 程。 3)下端有控制液流的活塞(一种是普通 玻璃活塞、另一种是橡皮管和玻璃球组 合的阀) [互动2]精确度更高、能精确到 (c) ;便 于控制液流。 [互动3]学生阅读后总结: 1)变色点尽量接近完全中和点时溶液的 pH; 2)变色要灵敏、明显; 3)…… |
| 认识滴 定管和 指示剂 | [互动3]既然指示剂的选择直接关系到酸或碱的用量,因 此,必须是最合适的指示剂。如何选择指示剂呢? [板书]选择指示剂的原因:一般是 (d) 。 [说明]决不用石蕊(颜色不易辨别,且变色范围过大) 强酸——强碱:…… 强酸——弱碱:…… 弱酸——强碱:…… | |
| 演示实 验操作 | [过渡]下面以0.1000mol/L HCl溶液滴定NaOH溶液为例, 讲解中和滴定实验的操作步骤和注意事项。 | 学生听讲并留心观察 |
