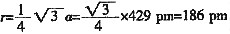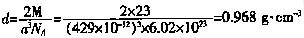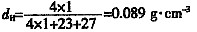一、选择题 6. 48g Fe溶于2L 0.1mol·L
-1 的稀硫酸,再加入50mL 0.4mol·L
-1 KNO
3 溶液后,其中的Fe
2+ 全部转化成Fe
3+ ,
也完全反应,生成一种氮氧化物N
y O
x ,则该氮氧化物的化学式是______。
A
[解析]
,则电子转移0.08mol,设N由+5→+x价,0.08=(5-x)×0.02,则x=1,N变为+1价,故选A。
8. 已知下列反应的热化学方程式:
6C(s)+5H
2 (g)+3N
2 (g)+9O
2 (g)====2C
3 H
5 (ONO
2 )
3 (1)ΔH
1 2H
2 (g)+O
2 (g)====2H
2 O(g) ΔH
2 C(s)+O
2 (g)====CO
2 (g)ΔH
3 则反应4C
3 H
5 (ONO
2 )
3 (1)====12CO
2 (g)+10H
2 O(g)+O
2 (g)+6N
2 (g)的ΔH为______。
A.12ΔH3 +5ΔH2 -2ΔH1 B.2ΔH1 -5ΔH2 -12ΔH3 C.12ΔH3 -5ΔH2 -2ΔH1 D.ΔH1 -5ΔH2 -12ΔH3
B
[解析] 6C(s)+5H2 (g)+3N2 (g)+9O2 (g)====2C3 H5 (ONO2 )3 (1)1 ①2 (g)+O2 (g)====2H2 O(g)2 ②2 (g)====CO2 (g) ΔH3 ③3 H5 (0N02 )3 (1)====12CO2 (g)+10H2 O(g)+O2 (g)+6N2 (g),所以ΔH=12ΔH3 +5ΔH2 -2ΔH1 。
12. 著名化学家徐光宪获得国家最高科学技术奖,以表彰他在稀土萃取理论方面作出的贡献。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce
4+ >Fe
3+ >I
2 。)下列说法正确的是______。
A.铈溶于氢碘酸的化学方程式可表示为:
B.用Ce(SO
4 )
2 溶液滴定硫酸亚铁溶液,其离子方程式为:Ce
4+ +2Fe
2+ ====Ce
3+ +2Fe
3+ C.在一定条件下,电解熔融状态的CeO
2 制Ce,在阴极获得铈
D.四种铈的核素
,它们互称为同素异形体
C
[解析] A项,金属铈可以和强酸HI反应生成盐和水,但是铈离子具有氧化性,碘离子具有还原性,二者可以继续发生氧化还原反应,故A错误;B项,氧化性是Ce
4+ >Fe
3+ ,所以用Ce(SO
4 )
2 溶液滴定硫酸亚铁溶液,其离子方程式为:Ce
4+ +Fe
2+ ====Ce
3+ +Fe
3+ ,故B错误;C项,电解熔融状态的CeO
2 ,电解池中在阴极是铈离子发生得电子的还原反应,即在阴极获得铈,故C正确;D项,同素异形体是同种元素组成的性质不同的单质间的互称,
属于四种原子,它们互为同位素,故D错误。
17. 下列离子或分子的水溶液组合中,能大量共存的是______。
A.
B.
C.
D.
A
[解析] B项,NH
3 ·H
2 O与Ag
+ 会发生反应,不能共存;C项,
不溶于水;D项,
与CH
3 CH
2 OH会发生氧化还原反应。
18. 在100mL某混合溶液中,c(HNO
3 )=0.4mol·L
-1 ,c(H
2 SO
4 )=0.1mol·L
-1 ,向其中加入1.92gCu粉,微热充分反应后溶液中的c(Cu
2+ )为______。
A.0.15mol·L-1 B.0.225mol·L-1 C.0.3mol·L-1 D.无法计算
B
[解析] 需要考虑过量、不足的问题
n(H
+ )=0.4×0.1+0.1×0.1×2=0.06mol
根据方程式
可见,H
+ 不足,要根据H
+ 计算
所以c(Cu
2+ )=0.225mol/L。
二、教学设计题 1. 阅读下列材料,完成教学设计。
材料一:《全日制义务教育化学课程标准(实验稿)》的“内容标准”:
“初步学习在实验室制取二氧化碳。”
材料二:义务教育课程标准使用教科书《化学》(九年级上册)的目标(略)。
材料三:人教版初中《化学》“二氧化碳的制取研究”部分教材内容(略)。
根据以上材料,回答下列问题:
(1)试确定本课的三维教学目标。
(2)说明本节课的教学重点和难点。
(3)简述本节可采用的教学方法和使用的教具。
(4)请对本课内容进行教学过程设计。
(1)知识与技能目标:①掌握实验室制取二氧化碳的反应原理和方法,知道二氧化碳的验证和验满方法;②能设计出实验室制取二氧化碳的简易装置,了解实验室制取气体的一般思路。
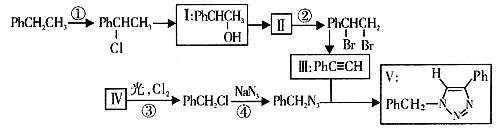
二、填空题 1. 叠氮化合物应用广泛,如NaN
3 可用于汽车安全气囊,PhCH
2 N
3 可用于合成化合物V(见下图,仅列出部分反应条件,Ph—代表苯基
)。
(1)下列说法不正确的是______(填字母)。
A.反应①、④属于取代反应
B.化合物工可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ能生成化合物Ⅰ
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
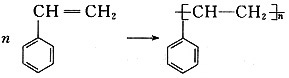
(2)化合物Ⅱ发生聚合反应的化学方程式为______(不要求写出反应条件)。
(3)反应③的化学方程式为______(要求写出反应条件)。
(4)化合物Ⅲ与PhCH
2 N
3 发生环加成反应生成化合物V,不同条件下环加成反应还可以生成化合物V的同分异构体。该同分异构体的分子式为______,结构式为______。
(5)科学家曾预言可合成C(N
3 )
4 ,其可分解成单质,用作炸药。有人通过NaN
3 与NC—CCl
3 反应成功合成了该物质。下列说法正确的是______(填字母)。
A.该合成反应可能是取代反应
B.C(N
3 )
4 与甲烷具有类似的空间结构
C.C(N
3 )
4 不可能与化合物Ⅲ发生环加成反应
D.C(N
3 )
4 分解爆炸的化学反应方程式可能为:
(1)B
(2)
(3)
(4)C
15 H
13 N
3 (5)ABD
[解析] 本题涉及的有机推断题主要体现在反应类型的判断、化学方程式的书写、分子式和结构式的书写等。
比较反应①前后有机物结构的差异,可以看出只是一个氯原子取代了氢,同理分析反应③、④也属于取代反应;而Ⅰ一Ⅱ一Ⅲ的转化则必然是醇的消去反应得到Ⅱ,然后加成,之后通过卤代烃的消去反应生成Ⅲ;因有机物Ⅲ结构的不对称性,还可以生成:
。比较NC—CCl
3 和C(N
3 )
4 的组成可以看出该反应是取代反应,A正确;C(N
3 )
4 中碳与甲烷中碳相似,其空间构型必然是正四面体结构,B正确;PhCH
2 N
3 与有机物Ⅲ反应只是叠氮结构部分发生变化,故C错。
推测结构,物质判断2. 某液体化合物A,相对分子量为60,其红外光谱IR在3300 cm
-1 处有强吸收峰;
1 H—NMR谱信号分别为:(δppm)=1.1(d,6H),3.8(七重峰,1H),4.0(s,1H);试推出A结构。
3. 黑色化合物不溶于水,但可溶于盐酸。稀释其盐酸溶液时,有白色沉淀B析出,酸化时,沉淀溶解。在溶液中通H
2 S时,生成一种褐黑色沉淀C,该沉淀可溶于Na
2 S
2 溶液生成化合物D,则A、B、C、D分别是什么。
SnO;SnOCl或Sn(OH)2 ;SnS;Na2 SnS3
[解析] (1)由红外光谱IR在3300 cm
-1 处有强吸收峰可知,该化合物中有羟基。化合物中有8个H,其相对分子量为60,可推出该化合物中有3个C原子。根据
1 H-NMR谱信号可推出化合物A的结构为
。
(2)略。
四、计算题 1. 金属钠晶体为体心立方结构,钠原子在晶胞的体对角线上互相接触,晶胞参数a=429pm(即每个体心立方晶胞的边长为429pm)。
(1)计算可知钠的原子半径为______pm,金属钠的理论密度______g·cm
-3 。
(2)1982年。我国化学家以NaCl为固体分散剂,对熔融金属钠直接氢化合成了晶体:NaH,大大地降低了生产成本。NaH具有NaCl型结构,晶胞参数a=488pm,已知Na
+ 的离子半径为102pm,则H
- 的离子半径为______pm。
(3)NaH是合成氢化铝钠NaAlH
4 的关键材料NaAlH
4 是很有前途的储氢材料,密度为1.2g·cm
-3 ,请估算NaAlH
4 的储氢性能(以H的密度表示)。
(1)
每个晶胞中含有2个钠原子,所以密度为
(2)2(rNa
+ +rH
- )=a
rH
- =0.5a-rNa
+ =0.5×488-102=142pm
(3)

 也完全反应,生成一种氮氧化物NyOx,则该氮氧化物的化学式是______。
也完全反应,生成一种氮氧化物NyOx,则该氮氧化物的化学式是______。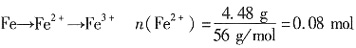 ,则电子转移0.08mol,设N由+5→+x价,0.08=(5-x)×0.02,则x=1,N变为+1价,故选A。
,则电子转移0.08mol,设N由+5→+x价,0.08=(5-x)×0.02,则x=1,N变为+1价,故选A。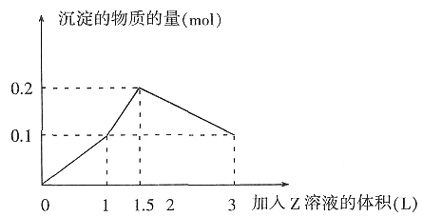
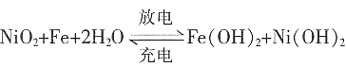 。该蓄电池的负极材料是______。
。该蓄电池的负极材料是______。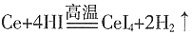
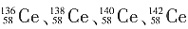 ,它们互称为同素异形体
,它们互称为同素异形体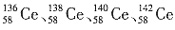 属于四种原子,它们互为同位素,故D错误。
属于四种原子,它们互为同位素,故D错误。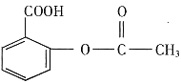 。它可以发生的反应类型的正确的组合是______。
。它可以发生的反应类型的正确的组合是______。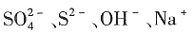
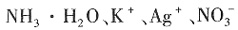
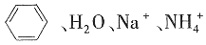
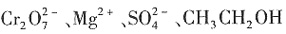
 不溶于水;D项,
不溶于水;D项,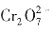 与CH3CH2OH会发生氧化还原反应。
与CH3CH2OH会发生氧化还原反应。
 )。
)。
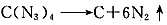
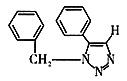
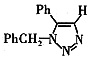 。比较NC—CCl3和C(N3)4的组成可以看出该反应是取代反应,A正确;C(N3)4中碳与甲烷中碳相似,其空间构型必然是正四面体结构,B正确;PhCH2N3与有机物Ⅲ反应只是叠氮结构部分发生变化,故C错。
。比较NC—CCl3和C(N3)4的组成可以看出该反应是取代反应,A正确;C(N3)4中碳与甲烷中碳相似,其空间构型必然是正四面体结构,B正确;PhCH2N3与有机物Ⅲ反应只是叠氮结构部分发生变化,故C错。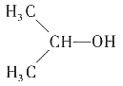
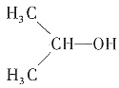 。
。